Überblick über die Dienstleistungen zur Einhaltung der EU IVDR
Die Europäische Verordnung über In-vitro-Diagnostika (EU IVDR) ist eine neue Rechtsgrundlage für das Inverkehrbringen von IVDs auf dem europäischen Markt. Die EU-IVDR-Verordnung soll die derzeitige EU-Richtlinie über In-vitro-Diagnostika (EU 98/79/EG) ersetzen. Als europäische Verordnung wird sie in allen Member States und den Staaten der Europäischen Freihandelsassoziation (EFTA) gelten, ohne dass sie in das Recht der jeweiligen Staaten übertragen werden muss. Als bewährter Partner in Regulierungsfragen bietet Freyr den Herstellern Dienstleistungen zur Einhaltung der EU-IVDR und IVDR-Beratungsdienste für die Konformität mit den In-vitro-Diagnosevorschriften und die CE-Kennzeichnung.
Die IVDR-Verordnung - Zeitplan für den Übergang
Die neue EU-IVDR, die ab dem 26. Mai 2022 in Kraft treten soll, wird als bedeutende Änderung der behördlichen Aufsicht über IVDs angesehen. Ein Überblick über die IVDR-Übergangsphase findet sich im Folgenden.
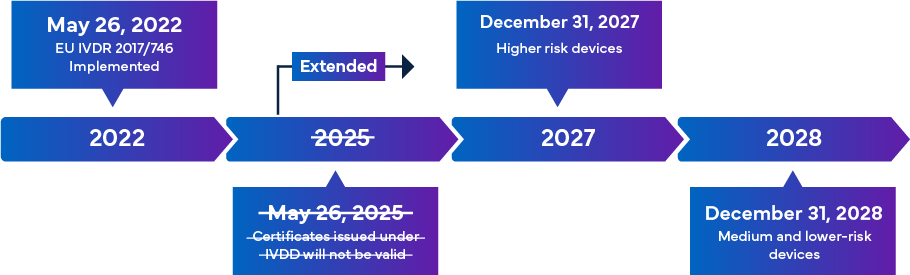
Nach ihrer vollständigen Umsetzung stellen die IVDR-Konformitätsregeln sicher, dass fast alle IVDs, die auf den europäischen Markt kommen, der Überprüfung durch die benannte Stelle (NB) und der CE-Kennzeichnung als Teil des IVD-Zulassungsverfahrens unterliegen. In diesem Szenario müssen die Hersteller nicht nur die aktualisierte IVDR-Klassifizierung einhalten, sondern auch die wichtigsten technischen Unterlagen für eine erfolgreiche IVD-Registrierung und CE-Kennzeichnung effektiv überprüfen. Die Anforderungen der IVDR variieren je nach Risikoklasse des IVD. Im Allgemeinen müssen die Hersteller für die IVD-Zertifizierung folgende Aufgaben erfüllen:
- Technische Aktenprüfungen gemäß der IVDR-Verordnung (Verordnung EU 2017/746)
- Erstellung von Leistungsbewertungsberichten (PER) für alle IVDs
- Erfolgskontrolle nach dem Inverkehrbringen (PMPF) gemäß Anhang XIII Teil B der IVDR
- Vigilanzmeldung gemäß Artikel 82 der IVDR
Freyr unterstützt Kunden bei der systematischen Überprüfung der wissenschaftlichen Literatur und hilft bei der Planung und Vorbereitung einer PER zur Einhaltung der Vorschriften für In-vitro-Diagnostika. Freyr verfügt über engagierte Experten, die IVDR-Beratungsdienste und Post-market Surveillance (PMS) anbieten, die zusammen mit der Überwachung der Leistung nach dem Inverkehrbringen (PMPF) ein integraler Bestandteil des Qualitätsmanagementsystems des Herstellers ist.
Kompetenz und Vorteile der EU IVDR Compliance Services
- Übergangsplan für die Einhaltung der IVDR
- Technische Überprüfung und Lückenanalyse der IVDR-Anforderungen für GSPR (Allgemeine Sicherheits- und Leistungsanforderungen)
- Unterstützung bei der Zusammenstellung der technischen Unterlagen gemäß den IVDR-Anforderungen
- Wissenschaftliche Validitätsberichte auf der Grundlage von Literatur und/oder internen Daten
- Klinische Leistungsberichte auf der Grundlage von Literatur und/oder internen Daten
- Klinische Nachweise oder Leistungsbewertungsberichte
- Protokolle und Berichte über die Überwachung der Leistung nach dem Inverkehrbringen (PMPF)
- Post-market Surveillance (PMS) und Berichte Post-market Surveillance (PMS)
- Erstellung/Überarbeitung anderer Dokumente wie Packungsbeilage/IFU (Gebrauchsanweisung), Kurzanleitung (QRI), Betriebs-/Benutzerhandbuch usw.

- Gesicherte IVDR-Konformität, IVD-Registrierung und CE-Kennzeichnung
- Ausgeprägtes regulatorisches Verständnis und Fachwissen in den wichtigsten Bereichen der EU IVDR
- Ausgeprägtes projektmanagementorientiertes Liefermodell zur Gewährleistung der Einhaltung des Zeitplans
- Interne Experten der BS (Überprüfung des Berichts durch die interaktiven Gutachter der BS)
- Fokussierte Teams mit übergreifendem Fachwissen über bestimmte Wirkungsbereiche und Gerätekategorien
- Funktionsübergreifende Beiträge von Experten für Medizinprodukte zur Erfüllung der Anforderungen
- Umfassende Dienstleistungen in den Bereichen Einhaltung, Überprüfung und Planung
- Ausgeprägte Erfahrung in der Aufrechterhaltung der Konsistenz der Ergebnisse (Zeit und Qualität)





