Überblick über die Dienstleistungen zur Einhaltung der EU MDR
Die EU-Verordnung über Medizinprodukte (MDR) ist am 26. Mai 2021 in Kraft getreten, nach einer dreijährigen Übergangszeit und einer zusätzlichen einjährigen Verlängerung aufgrund der COVID-19-Pandemie. Die Produkte, die jetzt auf den EU-Markt gebracht werden, müssen diesen Vorschriften entsprechen und von den nach diesen Vorschriften akkreditierten benannten Stellen gemäß der EU MDR CE-zertifiziert werden. Für Produkte, die bereits eine CE-Zertifizierung gemäß der EU-MDR erhalten haben, gilt jedoch eine Schonfrist, bevor sie die Anforderungen EU MDR vollständig erfüllen müssen. Während dieser Frist werden die sowohl nach der EU MDD als auch nach EU MDR zertifizierten Geräte gleichberechtigt und ohne Diskriminierung co auf dem Markt co. Freyr bietet unübertroffene Dienstleistungen zur Einhaltung der EU MDR , um Unternehmen im Bereich Medizinprodukte bei der rechtzeitigen Erfüllung der EU MDR zu unterstützen.
Zeitplan für den Übergang und neue Geräteklassifizierungen
Die European Medical Device Regulation (MDR) wird ab Mai 2021 in allen member states und den Staaten der Europäischen Freihandelsassoziation (EFTA) vollständig in Kraft treten und bietet den Herstellern eine Übergangsfrist von vier Jahren für die vollständige EU-MDR-Zertifizierung.
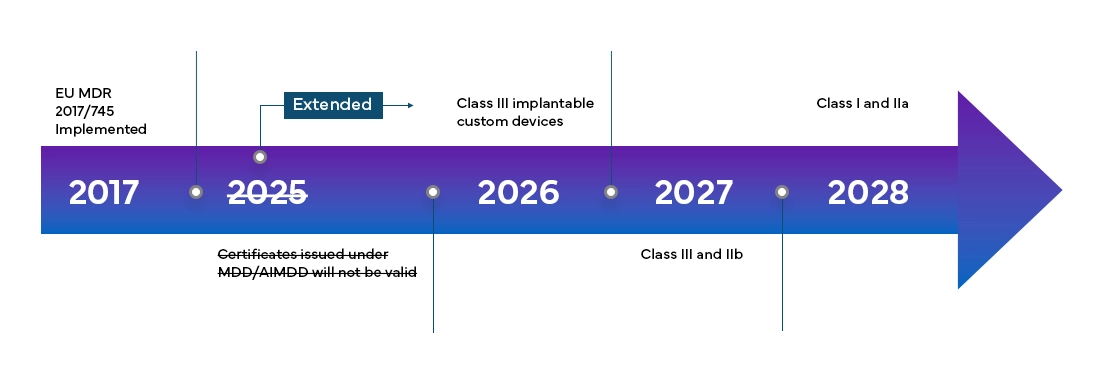
Die neue European Medical Device Regulation (MDR) hat, wie bereits erwähnt, auch Änderungen am bestehenden Klassifizierungssystem für Medizinprodukte mit sich gebracht:
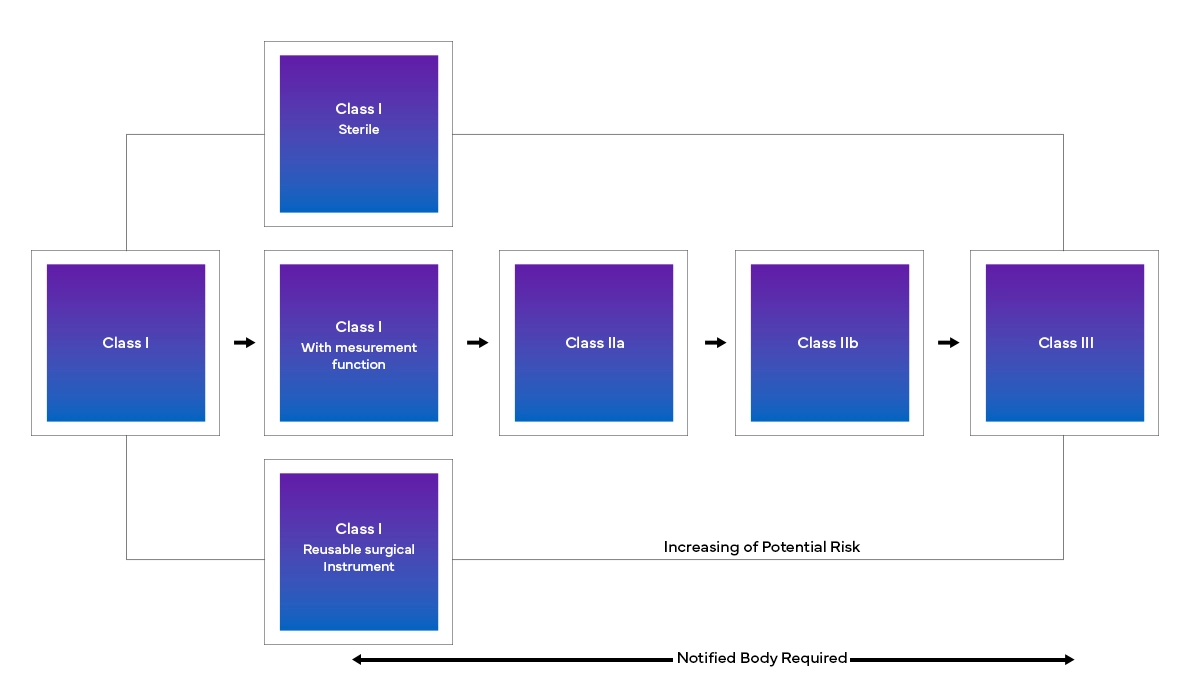
Von der Ermittlung der genauen Änderungen bis hin zu ihrer Umsetzung in Echtzeit müssen die Hersteller eine Reihe von Herausforderungen meistern, um die EU-MDR-Anforderungen zu erfüllen. Von der Entschlüsselung der neuen Struktur über die genaue Klassifizierung eines Geräts bis hin zur Zusammenstellung und Einreichung aller Daten ist ein detaillierterer und funktionsübergreifender regulatorischer Ansatz für Hersteller erforderlich, um die neuen europäischen Vorschriften für Medizinprodukte zu erfüllen. Mit einer strengen Gap-Analyse unterstützt Freyr seine Kunden beim Status Quo und bietet die notwendigen regulatorischen Maßnahmen für den Übergang und die Einhaltung der EU-MDR.
Dienstleistungen zur Einhaltung der EU MDR
- Entwicklung einer klaren Strategie zur Umsetzung der Medizinprodukteverordnung (MDR)
- Verständnis der neuen Gesetzgebung, Durchführung von Lückenanalysen zu den aktuellen Qualitätsmanagementsystemen (QMS) und den bestehenden Verfahren
- Entwicklung eines detaillierten Plans mit einem funktionsübergreifenden Ansatz zur Bestimmung der Aspekte des Qualitätssystems, die im Hinblick auf die neue EU-Verordnung über Medizinprodukte geändert werden müssen
- Bildung mehrerer Teams für die Analyse des Produktumfangs, die Klassifizierung, die Handhabung des QMS usw. innerhalb der Organisation, mit einer einzigen Kontaktstelle in jedem Team
- Zuweisung und Planung von Ressourcen
- Berücksichtigung des Zusammenspiels Ihres QMS mit anderen Vorschriften und Nutzung dieser Möglichkeit zur Rationalisierung von Prozessen bei gleichzeitiger Flexibilität für künftige Änderungen
- Analyse der vorhandenen Testdaten und Überprüfung auf zusätzliche Anforderungen, die die MDR stellt
- Koordinierung der Erwartungen und des Übergangsplans mit Ihren benannten EU-Stellen
- Lückenanalyse für bestehende Medizinprodukte von der EU MDD zur EU MDR
- End-to-end bei der Erstellung Clinical Evaluation Report (CER), einschließlich Literaturrecherche gemäß den Leitlinien European Medical Device Regulation EU MDR)
- End-to-end für Berichte zur Überwachung nach dem Inverkehrbringen (PMSR), regelmäßige Sicherheitsberichte (PSUR) und Zusammenfassungen der Sicherheit und klinischen Leistung (SSCP)
- Regulatorische Ressourcenerweiterung mit Onshore- und Offshore-Einsatzoptionen
- Dienstleistungen des Europäischen Bevollmächtigten (EAR)
- Unterstützung bei der Einhaltung der MDR und bei der Einreichung bei den benannten Stellen
- Regulatorische Informationen über den Importprozess verschiedener regulierter Märkte
- QMS-Konformität und Probeaudits
- Dokumentenmanagementsystem und Werkzeug für MDR-Unternehmen
- Einstufung und Neueinstufung von Produkten nach ihrem Risiko
- UDI-Implementierung und -Beratung
- EU-konforme Dienstleistungen zur Überwachung nach dem Inverkehrbringen von Medizinprodukten
- Risikomanagement ISO 14971 Beratung
- Interne und Online-Schulungen
- Verantwortliche Person für Dienstleistungen und Unterstützung bei der Einhaltung von Rechtsvorschriften
- Identifizierung von MDR-benannten Stellen

Für end-to-end Unterstützung end-to-end EU MDR reach an Freyr.