Ägypten Registrierung von Medizinprodukten Überblick
Seit September 2018 ist die Registrierung von Medizinprodukten in Ägypten obligatorisch geworden. Die Medizinprodukteindustrie in dem Land hat ein beständiges Wachstum erlebt und stellt einen attraktiven Markt für Hersteller und Händler dar. Mit einer Bewertung von 4,0 Milliarden US-Dollar im Jahr 2021 wird für den ägyptischen Markt für Medizinprodukte eine jährliche Wachstumsrate (CAGR) von über 3 % zwischen 2022 und 2027 prognostiziert. Angesichts der relativ geringen lokalen Produktion wird die Nachfrage nach Medizinprodukten in Ägypten weitgehend durch Importe gedeckt. Bemerkenswerterweise ist der ägyptische Markt für Medizinprodukte der zweitgrößte in der Region Naher Osten und Nordafrika (MENA). Dieser Überblick untersucht die wichtigsten Aspekte des ägyptischen Zulassungsverfahrens und bietet Einblicke in den rechtlichen Rahmen und die Anforderungen für die Einführung innovativer Medizinprodukte im ägyptischen Gesundheitssektor.
Aufsichtsbehörde: Ägyptische Arzneimittelbehörde (EDA)
Verordnung: Ägyptisches Medizinproduktegesetz Gesetz Nr. 10 von 2003
Regulierungspfad: Produktregistrierung (Normal- und Schnellverfahren) und amtliche Einstufung
Ägypten Lokaler Bevollmächtigter: Ägyptischer Registrierungsinhaber (ERH)
QMS-Anforderung: ISO 13485
Bewertung der technischen Daten: Das Drug Policy and Planning Center (DPPC) und die Central Administration of Pharmaceutical Affairs (CAPA).
Gültigkeit der Lizenz: Zehn (10) Jahre
Einreichungsformat: Papier und elektronisch
Übersetzung: Übersetzte Dokumente in Arabisch und Englisch
Klassifizierung der Geräte
In Ägypten entspricht die Klassifizierung von Medizinprodukten dem europäischen Klassifizierungssystem, das Medizinprodukte auf der Grundlage ihres Verwendungszwecks und der mit ihrer Verwendung verbundenen potenziellen Risiken einstuft. Die Hersteller sollten die korrekte Klassifizierung ihrer Produkte ermitteln, um die Einhaltung der gesetzlichen Anforderungen zu gewährleisten und die erforderlichen Genehmigungen für die Vermarktung und den Vertrieb in Ägypten zu erhalten.
Medizinprodukt-Klassen
| Klasse | Risiko |
|---|---|
| Klasse I | Niedrig |
| Klasse II a | Niedrig bis mittel |
| Klasse II b | Mittel-Hoch |
| Klasse III | Hoch |
Ägypten Örtlicher Bevollmächtigter
Medizinproduktefirmen mit Sitz außerhalb Ägyptens müssen einen lokalen Vertreter, den "Egyptian Registration Holder (ERH)", benennen, der in ihrem Namen die Einreichung von Registrierungsanträgen und Dossiers bei der EDA übernimmt. Der ERH fungiert als Bindeglied zwischen dem Hersteller und der Aufsichtsbehörde. Er sorgt für die korrekte Erstellung und Einreichung aller erforderlichen Unterlagen und prüft, ob das Medizinprodukt den Sicherheits-, Qualitäts- und Wirksamkeitsstandards der EDA entspricht. Darüber hinaus ist der ERH für die Aufbewahrung der Registrierungsunterlagen, die Meldung von Vorfällen oder Rückrufen und die Gewährleistung der kontinuierlichen Einhaltung aller geltenden Normen und Vorschriften während des gesamten Lebenszyklus des Produkts verantwortlich. Der ägyptische Registrierungsinhaber (ERH) ist vollständig für die Sicherstellung der Registrierung eines Medizinprodukts bei der EDA verantwortlich, insbesondere innerhalb der Zentralverwaltung für Medizinprodukte. In dieser Funktion stellt er sicher, dass das Produkt die regulatorischen Anforderungen der EDA für die Vermarktung und den Vertrieb in Ägypten erfüllt.
Registrierung von Medizinprodukten
Die Zulassung eines Medizinprodukts in Ägypten umfasst mehrere Schritte, darunter die Erstellung der erforderlichen Unterlagen, die Einreichung des Antrags bei der EDA, die Einhaltung der Anforderungen an das Klassifizierungs- und Qualitätssystem, die Ernennung eines ERH (falls erforderlich) und die Erfüllung der Verpflichtungen nach dem Inverkehrbringen. Der Registrierungsprozess ist von entscheidender Bedeutung, um zu gewährleisten, dass die Medizinprodukte den von der ägyptischen Regulierungsbehörde festgelegten Sicherheits-, Qualitäts- und Wirksamkeitsstandards entsprechen. Die erforderliche Dokumentation kann je nach gewähltem Registrierungsverfahren unterschiedlich sein, umfasst aber im Allgemeinen Folgendes:
- CE-Zertifikat (falls zutreffend).
- Bescheinigung über den freien Verkauf (CFS).
- ISO 13485 .
- Konformitätserklärung (DOC).
Prozessablauf
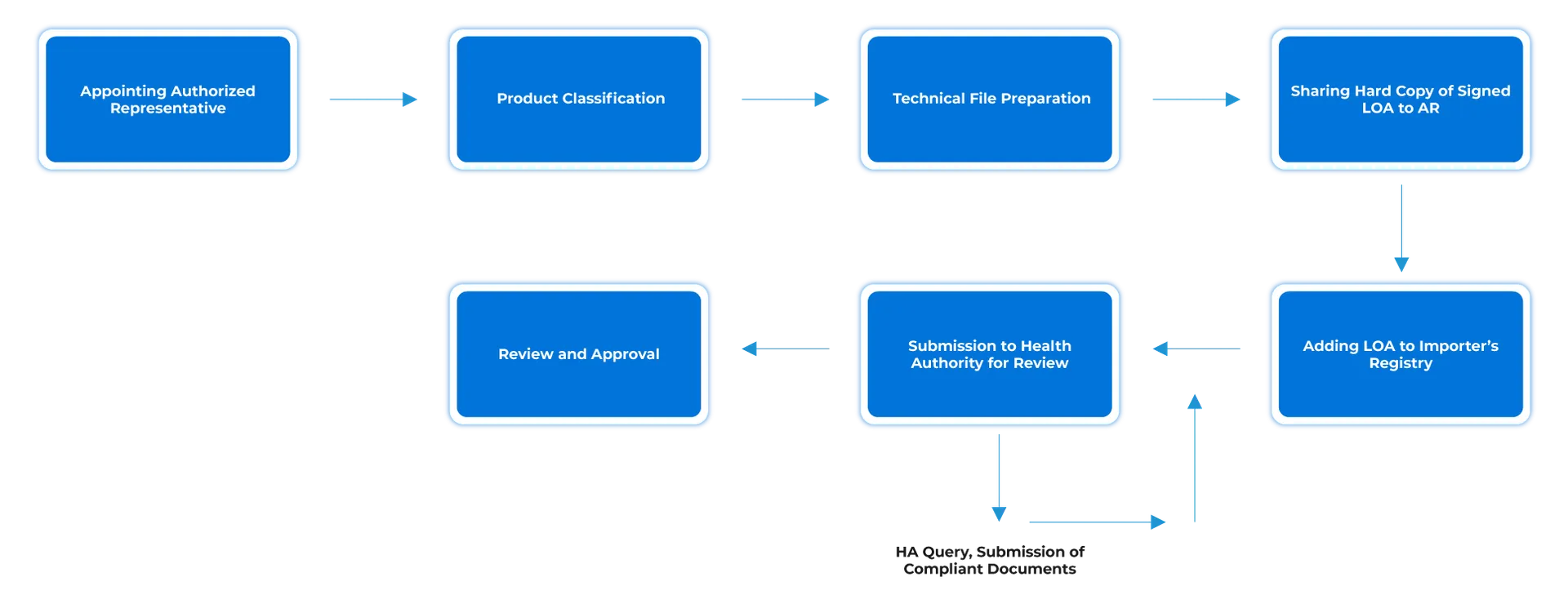
Management des Lebenszyklus von Geräten nach der Zulassung
Freyr bietet ausländischen Herstellern umfassende Unterstützung bei der Verwaltung des gesamten Lebenszyklus von Medizinprodukten in Ägypten, einschließlich der Aktivitäten nach der Zulassung:
- Änderungsmanagement nach der Zulassung, das sich mit Änderungen bestehender Zulassungen für Medizinprodukte befasst, z. B. mit der Hinzufügung neuer Varianten, von Zubehör und Anwendungsgebieten.
- Aufrechterhaltung der ISO 13485:2016.
- CE-Zertifizierung.
- Als Vermittler zwischen der benannten Stelle (BS) und dem Hersteller fungieren.
- Ein Vigilanzsystem zur Überwachung der Sicherheit des Medizinprodukts nach Erteilung der Genehmigung für das Inverkehrbringen.
- Bereitstellung regelmäßiger Updates zur Sicherheit und Wirksamkeit des Medizinprodukts sowie zu Änderungen des Zulassungsstatus in anderen Ländern.
- Erneuerung der Genehmigung für das Inverkehrbringen, je nach Art des Produkts und der Vorschriften, nach einer bestimmten Zeit.
Eine effektive Verwaltung Post-market Surveillance (PMS) Ägypten erfordert eine geschickte Navigation durch die von der EDA festgelegten regulatorischen Rahmenbedingungen. Marktteilnehmer, die mit diesen Komplexitäten zu kämpfen haben und keinen etablierten Partner im Bereich der Regulierung haben, können die umfangreichen regulatorischen Dienstleistungen von Freyr in Anspruch nehmen. Diese Dienstleistungen tragen zu einem reibungslosen Zulassungsprozess für Medizinprodukte in Ägypten bei und gewährleisten die kontinuierliche Einhaltung der sich ständig weiterentwickelnden regulatorischen Rahmenbedingungen und Marktdynamik.
Registrierung von Medizinprodukten in Ägypten Expertise
- Regulatorische Intelligenz.
- Regulatorische Sorgfaltspflicht.
- Klassifizierung von Medizinprodukten.
- Geräte-Registrierung.
- Inhaber der ägyptischen Registrierung.
- Unterstützung bei der Übersetzung.
- Medizinisches Schreiben.
- Unterstützung bei der Etikettierung.
- Identifizierung und Qualifizierung von Vertriebspartnern.
- Änderungsmanagement nach der Genehmigung.
- Erneuerung und Übertragung von Lizenzen.
- Zollabfertigung.
