
Registrierung von Medizinprodukten in Indonesien Überblick
Indonesien hat im Jahr 2014 eine allgemeine Gesundheitsversorgung für seine Bürger eingeführt. Dies hat das Wachstum des Marktes für Medizinprodukte stark beeinflusst und zu einem Anstieg der Einfuhr von Medizinprodukten geführt. Die Geräte in Indonesien werden von der National Agency of Drug and Food Control (NADFC) reguliert, die dem indonesischen Gesundheitsministerium untersteht. Die neueste Regelung für die Einfuhr von Medizinprodukten ist die Verordnung Nr. 62 aus dem Jahr 2017. Ausländische Unternehmen müssen für die Registrierung von Medizinprodukten in Indonesien einen lokalen Bevollmächtigten benennen.
Regulierungsbehörde: Nationale Agentur für Drogen- und Lebensmittelkontrolle (NADFC)
Verordnung: Nr. 62 / 2017
Bevollmächtigter Vertreter: Indonesien Bevollmächtigter Vertreter vor Ort
QMS-Anforderung: ISO 13485:2016
Bewertung der technischen Daten: NADFC
Gültigkeit der Lizenz: 5 Jahre
Kennzeichnungsvorschriften: Nr. 62 / 2017
Format der Einreichung: Online/Papier
Sprache: Englisch & Indonesisch
Indonesien Klassifizierung von Medizinprodukten
In der geltenden Verordnung werden die Produkte je nach Risiko in die Kategorien A, B, C und D eingeteilt.
| Risiko-Kriterien | Geräteklasse |
|---|---|
| Geringes Risiko | A |
| Gering Mäßiges Risiko | B |
| Mäßiges bis hohes Risiko | C |
| Hohes Risiko | D |
Indonesien Örtlicher Bevollmächtigter
Die indonesischen Vorschriften verlangen von den Herstellern, dass sie einen lokalen Vertreter mit einer Vertriebshändlerlizenz ernennen. Es kann ein Vertriebshändler ernannt werden, der den ausländischen Hersteller in Indonesien vertritt. Die Ernennung eines unabhängigen Dritten würde jedoch die Flexibilität bieten, den Vertriebshändler zu wechseln oder mehrere Vertriebshändler zu ernennen, um eine bessere Marktdurchdringung zu erreichen.
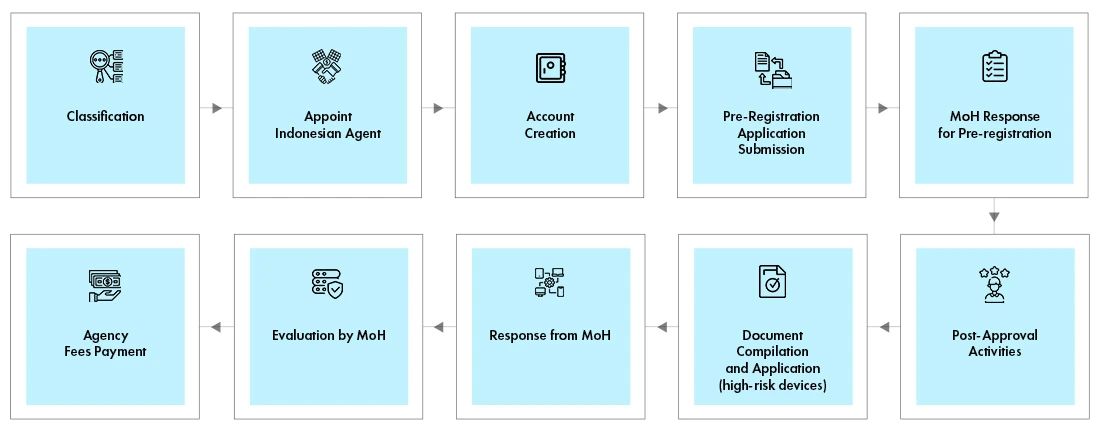
Indonesien Registrierung von Medizinprodukten
Der lokale Vertreter muss ein Konto im Online-Portal anlegen. Der Registrierungsprozess ist für alle Geräteklassen gleich. Die Anforderungen an die Dokumentation variieren jedoch je nach Geräteklasse. Die Registrierung ist ein zweistufiger Prozess.
- Vorregistrierungsprozess
- Bewertungsprozess
Das MoH überprüft die Klassifizierung des Produkts und legt die Kosten für die Bewertung fest. Das Ergebnis der Vorregistrierung wird dem Antragsteller zusammen mit der Rechnung per E-Mail zugesandt. Der lokale Vertreter nimmt im Namen des Herstellers die Zahlung vor und lädt den Zahlungsnachweis hoch. Das Gesundheitsministerium prüft die Dokumente und teilt dem Antragsteller die Ergebnisse per E-Mail mit. Einige Produkte müssen im Land selbst in einem akkreditierten Labor getestet werden.
Überblick über den regulatorischen Genehmigungsprozess
Das Expertenteam von Freyrbehält die sich ändernden Trends und Vorschriften im Auge und unterstützt die Beteiligten bei der Einhaltung der gesetzlichen Vorschriften während des gesamten Produktlebenszyklus. Wir bieten Lösungen für die Einhaltung anderer regulatorischer Aspekte im Rahmen begrenzter Budgets.
Klasse des Geräts | Risikoklasse | MoH Zeitpläne für Genehmigung für das Inverkehrbringen | MoH Zeitpläne für Erneuerung/Variation | ||
|---|---|---|---|---|---|
| Klassifizierungsprozess (Tage) | Bewertungsprozess (Tage) | Klassifizierungsprozess (Tage) | Bewertungsprozess (Tage) | ||
| Klasse A | Geringes Risiko | 7 | 45 | 7 | 45 |
| Klasse B | Gering Mäßiges Risiko | 7 | 90 | 7 | 45 |
| Klasse C | Mäßiges bis hohes Risiko | 7 | 100 | 7 | 45 |
| Klasse D | Hohes Risiko | 7 | 120 | 7 | 45 |
Freyr-Podcasts
- Regulatorische Due-Diligence-Prüfung
- Registrierung des Geräts
- Tests im Land selbst
- Vertriebspartner-Lizenzierung
- Legalisierung und notarielle Beglaubigung
- Juristischer Vertreter
- Labelling
- Unterstützung bei der Übersetzung
- Identifizierung und Qualifizierung von Händlern
- Post-Marketing-Überwachungsdienste
- Änderungsmanagement nach der Genehmigung
- Lizenzverlängerung und -übertragung
- Einreichungs- und Vermittlungsdienste

