Überblick über die Registrierung von Medizinprodukten in Israel
Die israelische Medizinprodukteindustrie erlebt ein anhaltendes Wachstum und Innovationen, die das Land zu einem Zentrum für Spitzentechnologien im Gesundheitswesen machen. Die Registrierung von Medizinprodukten ist für Unternehmen, die in diesen dynamischen Markt eintreten, von entscheidender Bedeutung. Dieser Überblick beleuchtet die wichtigsten Aspekte des israelischen Zulassungsverfahrens und bietet Einblicke in den rechtlichen Rahmen und die Anforderungen, um innovative Medizinprodukte an die Spitze des israelischen Gesundheitssektors zu bringen.
Aufsichtsbehörde: Die Abteilung für Medizinprodukte des israelischen Gesundheitsministeriums (AMAR).
Verordnung: Gesetz über medizinische Geräte und Ausrüstungen von 2012
Regulatorischer Weg: Produktregistrierung
Lokaler Bevollmächtigter in Israel: Israel Registration Holder (IRH)
QMS-Anforderung: ISO 13485
Bewertung der technischen Daten: Die Abteilung für Medizinprodukte des Gesundheitsministeriums
Gültigkeit der Lizenz: Fünf (05) Jahre
Einreichungsformat: Papier und elektronisch
Übersetzung: Übersetzte Dokumente auf Hebräisch
Klassifizierung der Geräte
Das Gesetz über Medizinprodukte und die Vorschriften für die Registrierung von Medizinprodukten in Israel enthalten kein Risikoklassifizierungssystem. Stattdessen orientiert sich Israel bei der Klassifizierung von Medizinprodukten an internationalen Standards, insbesondere an denen der Länder der Global Harmonization Task Force (GHTF). Alternativ dazu wird die Risikoklassifizierung eines Produkts in einem anerkannten Land für die Registrierung in Israel übernommen. Bei diesem Klassifizierungsverfahren werden in der Regel der Verwendungszweck, das Risikoniveau und andere Faktoren berücksichtigt, die sich auf die Sicherheit und Wirksamkeit von Medizinprodukten auswirken können.
Medizinprodukt-Klassen
| Klasse | Risiko |
|---|---|
| Klasse I | Niedrig |
| Klasse II | Niedrig bis mittel |
| Klasse III | Hoch |
Vorgeschlagene Änderungen der Registrierungsrouten
Die vorgeschlagenen Änderungen gelten für Produkte der Klassen I und II, während das Registrierungssystem für Produkte der Klasse III unverändert bleibt.
- Geräte der Klasse I können durch Selbsterklärung sofort registriert werden.
- Bei Geräten der Klasse II sind zwar Erklärungen und technische Unterlagen erforderlich, AMAR kann jedoch das Verfahren für Geräte mit geringem bis mittlerem Risiko auf vierzehn (14) Tage verkürzen. Dies gilt, wenn der Hersteller über zwei (02) Zulassungen aus anerkannten Ländern verfügt und Marktdaten für sechs (06) Monate vorlegt. Alternativ wird für Geräte der Klasse II, die nur über die US FDA (k) und sechs (06) Monate US verfügen, die Bearbeitungszeit von AMAR auf sechzig (60) Tage verkürzt.
Israel Örtlicher Bevollmächtigter
Medizinproduktefirmen mit Sitz außerhalb Israels müssen einen israelischen Registrierungsinhaber (IRH) benennen, der die Registrierung ihrer Produkte für den Verkauf im Lande erleichtert. Der IRH fungiert als lokaler Vertreter des Herstellers und hat die Aufgabe, sich mit dem Gesundheitsministerium in Verbindung zu setzen, um die Einhaltung der lokalen Vorschriften zu gewährleisten. Darüber hinaus ist eine IRH dafür verantwortlich, eine Geschäftspräsenz in Israel aufzubauen und aufrechtzuerhalten sowie eine gültige Geschäftslizenz zu erhalten und aufrechtzuerhalten.
Registrierung von Medizinprodukten
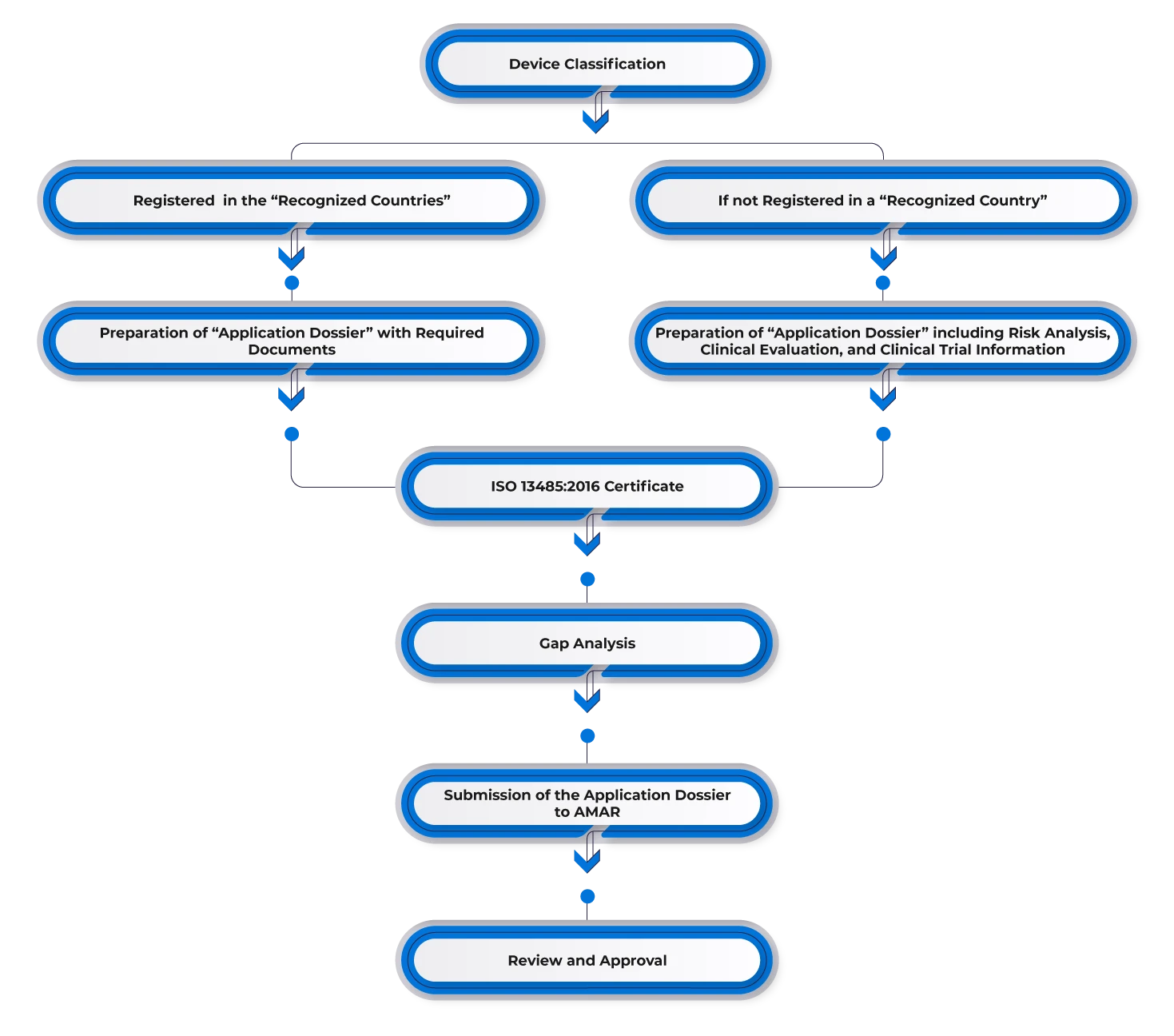
Um ein Medizinprodukt in Israel zu registrieren, müssen die Hersteller eine vorherige Zulassung in einem der Referenzmärkte wie den USA, Europa, Australien, Kanada oder anderen wichtigen Märkten erhalten. Hersteller mit bestehenden Zulassungen in einem der Referenzländer können diese Zulassung für den israelischen Markt nutzen und einen Vertreter im Land benennen. Anschließend müssen sie die erforderlichen Unterlagen einreichen, darunter:
- FDA 510(k)/Zulassungsschreiben/CE.
- Bescheinigung an eine ausländische Regierung (CFG)/Freiverkaufszertifikat (CFS).
- ISO 13485 oder eine andere anerkannte GMP-Zertifizierung (Good Manufacturing Practices).
- Validierung und Zertifizierung durch das israelische Normungsinstitut (falls erforderlich).
Prozessablauf
Management des Lebenszyklus von Geräten nach der Zulassung
Freyr bietet ausländischen Herstellern umfassende Unterstützung bei der Verwaltung des gesamten Lebenszyklus von Medizinprodukten in Israel, einschließlich Aktivitäten nach der Zulassung:
- Änderungsmanagement nach der Zulassung, das sich mit Änderungen bestehender Zulassungen für Medizinprodukte befasst, z. B. mit der Hinzufügung neuer Varianten, von Zubehör und Anwendungsgebieten.
- Aufrechterhaltung der ISO 13485:2016- und CE-Zertifizierung.
- Erneuerung von Lizenzen.
- Als Vermittler zwischen der benannten Stelle (BS) und dem Hersteller fungieren.
Die Navigation durch die Feinheiten der Zulassungsbehörden und die Einhaltung mehrerer Vorschriften für die Zulassung von Medizinprodukten kann eine Herausforderung sein. Die Einholung von Zulassungen aus verschiedenen GHTF-Ländern und die Einhaltung der jeweiligen staatlichen Vorschriften erfordern fundierte Kenntnisse im Bereich der Regulierung. Für Marktteilnehmer, die ohne einen etablierten Partner im Bereich der Regulierung mit diesen Komplexitäten konfrontiert sind, Freyr end-to-end Dienstleistungen end-to-end Freyr , die den Zulassungsprozess für Medizinprodukte in Israel vereinfachen.
Registrierung von Medizinprodukten in Ägypten Expertise
- Israel Medizinprodukte-Klassifizierung.
- Israelischer Registrierungsinhaber (IRH).
- Israel Geräte-Registrierung.
- ISO 14971:2019 Risikomanagement-Beratung.
- Einhaltung der ISO 13485:2016.
- Überprüfung, Zusammenstellung und Einreichung des Entwurfsdossiers.
- Registrierung von Medizinprodukten über das Online-Registrierungssystem.
- Bericht über die Regulierungsstrategie für Medizinprodukte.
- Testunterstützung - Biokompatibilität, elektrische Sicherheit, Mechanik und Leistung.
- Unterstützung bei der Einhaltung von Etikettierungsvorschriften.
- GMP-Unterstützung.
- Post-market Surveillance (PMS) .
