Überblick über die Registrierung von Medizinprodukten in den VAE
Die Vereinigten Arabischen Emirate (VAE), ein wichtiges GCC-Mitglied, verfügen über ein fortschrittliches Gesundheitssystem. Ihr Marktpotenzial ist erwiesen und steigt stetig an. Sie werden von der Abteilung für Arzneimittelkontrolle des Ministeriums für Gesundheit und Prävention (MOHAP) verwaltet. Die zentralisierte Verwaltung und sprachliche Barrieren sind die Haupthindernisse für die Registrierung von Medizinprodukten in den VAE, zusammen mit der sprachlichen Komplexität und dem Mangel an effizienten Kommunikationskanälen mit den Gesundheitsbehörden.
Regulierungsbehörde: Abteilung für Drogenkontrolle des Ministeriums für Gesundheit und Prävention (MOHAP)
Verordnung: Leitfaden zur Registrierung von Medizinprodukten in den VAE
Regulierungspfad: Produktregistrierung
Bevollmächtigter Vertreter: Bevollmächtigter Vertreter der VAE vor Ort erforderlich
QMS-Anforderung: ISO 13485:2016
Bewertung der technischen Daten: Ausschuss für die Registrierung von Medizinprodukten
Gültigkeit der Lizenz: 5 Jahre
Kennzeichnungsvorschriften: Anhang 2 (2.5) des Leitfadens zur Registrierung von Medizinprodukten der VAE
Format der Einreichung: Papier
Sprache: Englisch
Klassifizierung von Medizinprodukten in den VAE
Die VAE verfügen über separate Klassifizierungsregeln für Medizinprodukte und IVDs. Die Klassifizierungsregeln für Medizinprodukte in den VAE entsprechen den Klassifizierungsregeln der EU-Richtlinien für Medizinprodukte. Die Produktklassen gemäß den VAE-Klassifizierungsregeln lauten wie folgt
| Risiko-Kriterien | Medizinische Geräteklasse |
|---|---|
| Geringes Risiko | I |
| Gering Mäßiges Risiko | IIa |
| Mäßiges bis hohes Risiko | IIb |
| Hohes Risiko | III |
| Risiko-Kriterien | IVD-Klasse |
|---|---|
| Geringes individuelles Risiko und geringes Risiko für die öffentliche Gesundheit | A |
Mäßiges individuelles Risiko und/oder geringes Risiko für die öffentliche Gesundheit | B |
Hohes individuelles Risiko und/oder Mäßiges Risiko für die öffentliche Gesundheit | C |
| Hohes individuelles Risiko und hohes Risiko für die öffentliche Gesundheit | D |
UAE Lokaler Bevollmächtigter
Ausländische Hersteller, die über keine Niederlassung verfügen, ernennen einen lokalen Vertreter (LR), der in ihrem Namen handelt. Der örtliche Vertreter sollte vom Gesundheitsministerium als medizinisches Geschäft oder wissenschaftliches Büro zugelassen sein (im Falle eines wissenschaftlichen Büros sollten die Einfuhr- und Vertriebsaktivitäten von einem zugelassenen medizinischen Geschäft durchgeführt werden). Die Antragsteller können ihren Vertriebshändler als ihren örtlichen Vertreter benennen. Ein unabhängiger lokaler Repräsentant ohne kommerzielle Interessen würde jedoch die erforderliche Flexibilität bieten, um mehrere Vertriebshändler in den VAE zu benennen. Die Angaben sowohl zum LR als auch zum Händler müssen bei der Produktregistrierung gemacht werden.
Offizielle Klassifizierung Prozess mit UAE MoHAP
Das MoHAP der VAE hat einen offiziellen Klassifizierungsdienst eingeführt, der besonders nützlich ist, wenn Sie nicht sicher sind, ob Ihr Produkt registriert werden muss. Dieser Dienst klassifiziert Produkte aller Art und Form auf der Grundlage ihrer Aufmachung, Zusammensetzung, Verwendung und Gestaltung. Die Anforderungen können je nach Art, Risikoklasse und gesetzlichem Status des Produkts variieren.
Der Klassifizierungsbrief gibt an, ob ein Produkt beim MOHAP registriert werden muss. Wenn eine Registrierung erforderlich ist, muss das Produkt entsprechend der im Klassifizierungsschreiben angegebenen Klasse registriert werden. Dieses Schreiben ist ab dem Ausstellungsdatum drei Jahre lang gültig.
Die offiziellen Klassifizierungsergebnisse können sein:
- Erfordert keine MOHAP-Registrierung
- Zugelassen vom MOHAP der VAE als Medizinprodukt, beschränkt auf den professionellen Gebrauch
- Vom MOHAP der VAE als frei verkäufliches Medizinprodukt zugelassen
Registrierung von Medizinprodukten in den VAE
Bestimmte Produkte, die keine Produktregistrierung oder vorherige Auflistung oder Genehmigung für die Einfuhr benötigen. Solche Produkte, die von der Registrierung oder Auflistung ausgenommen sind, müssen eine Einfuhrgenehmigung beantragen und erhalten, um in den VAE vermarktet zu werden.
Für andere Geräte wird die Einfuhr nur dann freigegeben, wenn die DRCD eine Vorabgenehmigung für die Einfuhr der Sendung erteilt hat. Solche Produkte müssen entweder gelistet oder für die Einfuhr in die VAE registriert sein.
Auflistung von Produkten: Im Allgemeinen werden Produkte, die in Krankenhäusern unter fachlicher Aufsicht verwendet werden, sowie Produkte der Klasse I keiner detaillierten Bewertung unterzogen und müssen gelistet werden. Die Agentur stellt eine Zulassungsbescheinigung aus. Nach der Aufnahme in die Liste müssen die Produkte eine Einfuhrgenehmigung für die Vermarktung in den VAE erhalten.
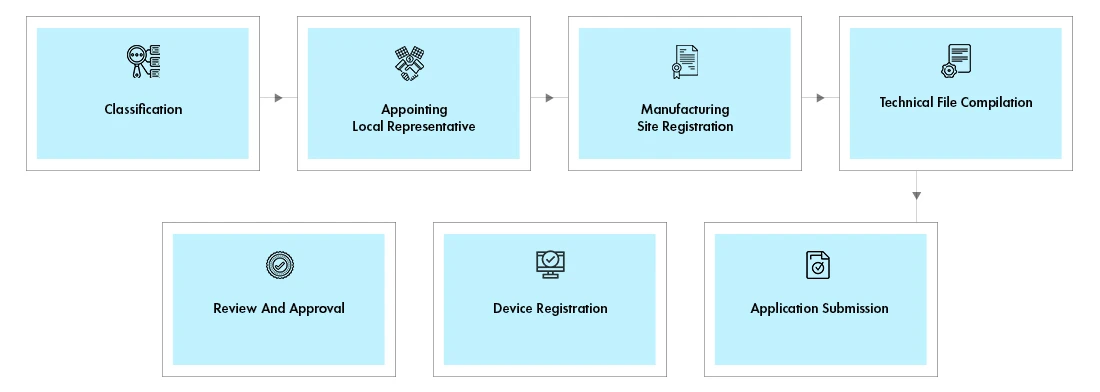
Registrierung von Geräten: Die Registrierung umfasst die Standort- und Produktregistrierung.
- Standortregistrierung:Der Herstellungsstandort muss registriert werden, wenn das an diesem Standort hergestellte Produkt zum ersten Mal in die VAE eingeführt wird. Für nachfolgende Produkte, die am selben Standort hergestellt werden, reicht die Registrierung des Produkts aus, eine Registrierung des Standorts ist nicht erforderlich.
- Geräteregistrierung:Diese Geräte unterliegen der Überprüfung durch den technischen Ausschuss, der nach Genehmigung ein Lizenzzertifikat erteilt.
Prozessablauf
Management des Lebenszyklus von Geräten nach der Zulassung
- Änderungsmanagement nach der Zulassung - Änderungen bestehender Zulassungen für Medizinprodukte, z. B. Hinzufügung neuer Varianten und Zubehörteile, Hinzufügung neuer Anwendungsgebiete usw.
- Aufrechterhaltung von Zulassungen und Registrierung durch rechtzeitige Zahlung von Verwaltungs- und Registrierungsgebühren
- Erneuerung von Lizenzen
- Kontaktaufnahme zwischen dem Gesundheitsministerium und dem Hersteller
- Verwaltung der Einfuhren
Mit einem exklusiven Auslieferungszentrum in Dubai verfügt Freyr über einen maßgeblichen Überblick über den Markt für medizinische Geräte in den VAE und beschreibt die Geräteklassifizierung sowie die Entschlüsselung der Richtlinien für eine bessere Einhaltung der Vorschriften. Wir unterstützen unsere Kunden bei der Zusammenstellung von Dokumenten gemäß den Normen und sorgen so für schnelle Genehmigungen. Freyr bietet ein komplettes Spektrum an regulatorischen Dienstleistungen für die erfolgreiche Vermarktung von Produkten.
Zusammenfassung
| Typ des Geräts | Geräteauflistung | Registrierung des Geräts | Importlizenz |
|---|---|---|---|
Von der Voreinfuhrgenehmigung befreites Gerät (wie in Anhang 3 aufgeführt) | NA | NA | YES |
| YES | NA | YES |
| Alle anderen Geräte | NA | YES | YES |
Freyr-Podcasts
- Regulatorische Intelligenz
- Regulatorische Due Diligence
- Formelle Klassifizierung von Medizinprodukten
- Registrierung des Geräts
- UAE Bevollmächtigte Vertretung
- Unterstützung bei der Übersetzung
- Unterstützung bei der Etikettierung
- Identifizierung und Qualifizierung von Händlern
- Änderungsmanagement nach der Genehmigung
- Erneuerung und Übertragung von Lizenzen
- Zollabfertigung