Regulatorische Dienstleistungen für Medizinprodukte
in Singapur Übersicht
Medizinprodukte unterliegen in Singapur dem Health Products Act (HPA) und dessen Health Product (Medical Devices) Regulations 2010.
Regulierungsbehörde: Behörde für GesundheitswissenschaftenHSA)
Verordnung: Verordnung über Gesundheitsprodukte (Medizinprodukte) 2010
Regulierungspfad: Abteilung Medizinprodukte der Behörde für GesundheitswissenschaftenHSA)
Bevollmächtigter Vertreter: Singapur Registrant
QMS-Anforderung: SS 620:2016, Singapur-Norm für gute Vertriebspraxis für Medizinprodukte, und ISO 13485:2016
Bewertung der technischen Daten: Behörde für GesundheitswissenschaftenHSA)
Gültigkeit der Lizenz: Alle Händlerlizenzen sind ab dem Datum der Zulassung 12 Monate lang gültig.
Labelling : Regulierungsleitfaden, GN- 23 Revidiert (1. März 2020)
Format der Einreichung: Online
Sprache: Englisch
HSA von Medizinprodukten
Die HSA wendet 16 Regelwerke an, um die Medizinprodukte vom niedrigsten bis zum höchsten Risiko in die Klassen A, B, C und D einzustufen.
Die Risikoeinstufung hängt von Faktoren wie Dauer des Kontakts, Grad der Invasivität, Verwendungszweck und Verabreichungsmethode ab.
Klassifizierung von Medizinprodukten, HSA
| Risikoklasse | Risikostufe | Beispiele für medizinische Geräte |
|---|---|---|
| Klasse A | Geringes Risiko | Filmbetrachter, chirurgische Hand, Scheide, Sauerstoffmaske |
| Klasse B | Geringes bis mittleres Risiko | Blutdruckmanschette, Schaftsterilisator |
| Klasse C | Mäßiges bis hohes Risiko | Patientenmonitor, Mesin-Röntgenbild |
| Klasse D | Hohes Risiko | Herzstents, Herzschrittmacher |
IVD-Klassifizierung
In-Vitro-Medizinprodukte werden nachstehend vom niedrigsten zum höchsten Risiko eingestuft.
Risikoklasse | Risikostufe | Beispiele für In-vitro-Medizinprodukte |
|---|---|---|
| Klasse A | Geringes individuelles Risiko und geringes Risiko für die öffentliche Gesundheit | Probengefäß |
| Klasse B | Mäßiges individuelles Risiko oder geringes Risiko für die öffentliche Gesundheit oder beides | Vitamin B12, Schwangerschaftsselbstuntersuchung, antinukleäre Antikörper, Urinteststreifen |
| Klasse C | Hohes individuelles Risiko oder mäßiges Risiko für die öffentliche Gesundheit oder beides | Blutzuckerselbsttest, HLA-Typisierung, PSA , Röteln-IgM |
| Klasse D | Hohes individuelles Risiko und hohes Risiko für die öffentliche Gesundheit | HIV-Blutspender-Screening, HIV-Diagnosekit |
Singapur Bevollmächtigter für Medizinprodukte / Registrant
Ein Registrant ist das Bindeglied zwischen Ihrem Unternehmen und der HSA, who sich um die Produktregistrierung in Singapur kümmert. Der bevollmächtigte Vertreter für Medizinprodukte in Singapur bearbeitet den Registrierungsantrag bei der HSA und ist Eigentümer Ihrer HSA . Nur in Singapur ansässige Unternehmen oder Einrichtungen können als Registrant fungieren; sie müssen auch bei der HSA registriert sein.
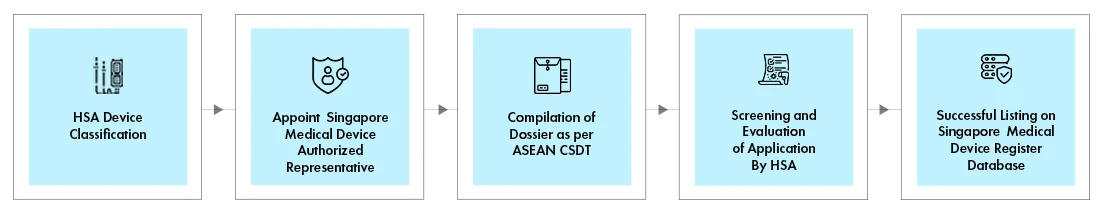
HSA Registrierung von Medizinprodukten
Das HSA für Medizinprodukte wird über das HSA und Kommunikationssystem für Medizinprodukte (MEDICS) durchgeführt. Jede HSA erfolgt über eine spezifische Bewertungsroute, die von den folgenden Punkten abhängt:
- Risikoklassifizierung des Produkts.
- Anzahl der vorherigen Genehmigungen, die von den ausländischen Referenzbehörden erteilt wurden.
- Dauer der Sicherheitsvermarktung des Produkts.
Der Bewertungsweg des Geräts bestimmt die Bearbeitungszeit (TAT), die Gebühren und die für die Registrierung erforderlichen Dokumente.
Registrierung der Klasse A - Medizinprodukte der Klasse A sind von der Produktregistrierung befreit. Bei der Beantragung der Händlerlizenz muss jedoch die Ausnahmeliste der Klasse A in MEDICS ausgefüllt werden.
Prozessablauf
Management des Lebenszyklus von Geräten nach der Zulassung
Freyr ausländische Hersteller beim end-to-end Lebenszyklusmanagement end-to-end , einschließlich Aktivitäten nach der Zulassung, wie zum Beispiel:
- Änderungsmanagement nach der Zulassung - Änderungen bestehender Zulassungen für Medizinprodukte, z. B. Hinzufügen neuer Varianten und Zubehörteile, Hinzufügen neuer Anwendungsgebiete usw.
- Aufrechterhaltung der Zulassungen und Registrierung von Medizinprodukten durch rechtzeitige Zahlung der Verwaltungs- und Registrierungsgebühren.
- Erneuerung der Lizenz.
Mit einem professionellen Team für regulatorischen Support unterstützt Freyr Hersteller bei der Einhaltung der für die Zulassung erforderlichen Qualität und Sicherheit. Die Intelligenzexperten von Freyrbeobachten aufmerksam die Aktualisierungen der Vorschriften und informieren die Kunden über die Schritte, die zur Einhaltung der geltenden Normen zu unternehmen sind.
Zusammenfassung
Die Bearbeitungszeit für die Produktregistrierung ist in der folgenden Tabelle aufgeführt.
| Risikoklasse | Unmittelbar | Versandt | Gekürzt | Vollständige Bewertung | Vollständig (Priority Review Scheme) |
|---|---|---|---|---|---|
| Klasse B | Sofortige Registrierung bei Einreichung | 100 Arbeitstage | 160 Arbeitstage | 120 Arbeitstage | |
| Klasse C | Sofortige Registrierung bei Einreichung (nur für eigenständige medizinische mobile Anwendungen der Klasse C) | 120 Arbeitstage | 160 Arbeitstage | 220 Arbeitstage | 165 Arbeitstage |
| Klasse D | 180 Arbeitstage | 220 Arbeitstage | 310 Arbeitstage | 235 Arbeitstage | |
| Klasse D (Produkte, die Arzneimittel enthalten) | 220 Arbeitstage | 310 Arbeitstage |
Die Bearbeitungszeit für eine Änderung des Registranten beträgt 40 Arbeitstage.
HINWEIS-
- Medizinprodukte der Klasse A sind von der Produktregistrierung ausgenommen.
- Die Bearbeitungszeit schließt die Zeit aus, die für die Beantwortung von Ersuchen um Klarstellung oder zusätzliche Informationen durch die HSA während der Bewertungsphase benötigt wird.
Freyr-Podcasts
- Regulatorische Due Diligence für die Produktregistrierung bei der HSA, Singapur
- HSA Klassifizierung und Gruppierung von Medizinprodukten
- Unterstützung bei der Bewertung durch die Konformitätsbewertungsstelle (CAB)
- ASEAN Common Submission Dossier Template (CSDT) Dossierzusammenstellung
- HSA ;
- Rechtliche Vertretung
- Unterstützung bei der Etikettierung
- Identifizierung und Qualifizierung von Vertriebspartnern
- Überwachung nach der Markteinführung
- Änderungsmanagement nach der Genehmigung
- Lizenzverlängerung und Übertragung
- Einreichungs- und Verbindungsdienste mit der HSA