Überblick über die Registrierung von Medizinprodukten in Neuseeland
Medizinprodukte werden in Neuseeland von der neuseeländischen Behörde für die Sicherheit von Arzneimitteln und Medizinprodukten (Medsafe) gemäß den Arzneimittelverordnungen von 1984, dem Arzneimittelgesetz von 1981 und den Arzneimittelverordnungen (Datenbank für Medizinprodukte) von 2003 geregelt. Eine Zulassung vor dem Inverkehrbringen ist zwar nicht erforderlich, doch müssen die Produkte innerhalb von 30 Tagen nach der Markteinführung in die elektronische Datenbank WAND (Web Assisted Notification of Devices) aufgenommen werden. Medsafe kann eine Dokumentation zum Nachweis der Sicherheit und Wirksamkeit verlangen, z. B. eine Zertifizierung durch anerkannte Stellen wie eine benannte EU-Stelle oder Health Canada.
Das Team von Freyr, das sich aus Experten für die Regulierung von Medizinprodukten zusammensetzt, verfügt über beträchtliche Erfahrung bei der Begleitung von Medizinproduktunternehmen durch das Medsafe-Registrierungsverfahren für Medizinprodukte in Neuseeland.

Regulierungsbehörde: Behörde für die Sicherheit von Medizinprodukten (Medsafe)
Verordnung:The Medicines (Database of Medical Devices) Regulations, 2003
Medicines Act 1981
Medicines Regulation 1984
Regulierungspfad: Elektronisches System für die webgestützte Benachrichtigung von Geräten (WAND)
Bevollmächtigter Vertreter: Medizinprodukt Sponsor
QMS-Anforderung: Zertifizierung ISO 13485:2016
Bewertung der technischen Daten: Behörde für die Sicherheit von Medizinprodukten (Medsafe)
Gültigkeit der Lizenz: Die Auflistung der Produkte in Neuseeland läuft nicht ab. Geräte, die eine große Gefahr für die Öffentlichkeit darstellen, können vom Markt genommen werden.
Kennzeichnungsvorschriften: Verordnung 12(4) der Arzneimittelverordnung von 1984 und GHTF/SG1/N43:2005
Format der Einreichung: Elektronisches System für die webgestützte Benachrichtigung von Geräten (WAND)
Sprache: Englisch
Neuseeländische Klassifizierung von Medizinprodukten
Medizinprodukte werden in Neuseeland nach dem Risiko in die Klassen I, IIa, IIb, III und AIMD gemäß den Kriterien des International Medical Device Regulators Forum (IMDRF) eingeteilt. Diese Einstufung wirkt sich auf den Umfang der erforderlichen behördlichen Kontrolle aus. Die Klassifizierung basiert auf Merkmalen wie der Zweckbestimmung des Produkts, der Dauer des Kontakts mit dem Körper, der Invasivität und der Tatsache, ob es aktiv oder inaktiv ist. Geräte höherer Klassen unterliegen einer strengeren behördlichen Aufsicht. Medsafe ist die neuseeländische Regulierungsbehörde, die diese Klassifizierungen und Vorschriften überwacht.
| Medsafe-Klassifizierung von Medizinprodukten, die keine IVDs sind Klasse | Risiko |
|---|---|
| Klasse I Basic | Geringes Risiko |
| Messung der Klasse I | Geringes Risiko |
| Klasse I steril | Geringes Risiko |
| Klasse IIa | Geringes bis mittleres Risiko |
| Klasse IIb | Mittleres bis hohes Risiko |
| Klasse III & Aktives implantierbares medizinisches Gerät (AIMD) | Hohes Risiko |
| Medsafe IVD-Klassifizierung | Risiko |
|---|---|
| Seit Juli 2014 erkennt Medsafe kein Risikoklassifizierungssystem für IVDs mehr an. Alle an WAND gemeldeten IVDs müssen den Risikoklassifizierungscode des IVDs verwenden. Der Generaldirektor für Gesundheit hat die Ausnahme für IVDs gemäß Schedule 1, Paragraph (i) der Medicines (Database of Medical Devices) Regulations 2003 genehmigt. Die Anbieter von IVDs können ihre Produkte jedoch freiwillig an die Datenbank melden. | |
Bevollmächtigter für Medizinprodukte/Sponsor
Der bevollmächtigte Vertreter wird als Sponsor bezeichnet und fungiert als Vermittler zwischen dem Hersteller und Medsafe. Die Sponsoren dienen als regulatorische Vertreter für Produkte, die in Neuseeland vermarktet werden, reichen WAND-Anträge ein und fungieren als Hauptansprechpartner zwischen dem Hersteller und Medsafe für alle produktbezogenen Angelegenheiten. Darüber hinaus macht Medsafe den Sponsor für die Vigilanzbemühungen verantwortlich.
Registrierung von Medizinprodukten in Neuseeland
Das Verfahren für die Registrierung von Medizinprodukten in Neuseeland und das Verfahren für die WAND-Listung in Neuseeland hängt von der Klasse des Produkts ab.
Produkte der Klasse I - Für nicht sterile, nicht messende Geräte der Klasse I ist eine Konformitätserklärung des Herstellers erforderlich; diese wird jedoch nur selten bei einer Aufsichtsbehörde eingereicht. Stattdessen muss der Sponsor (oder Lieferant) die Einzelheiten des Produkts im Rahmen des Medsafe-Meldeverfahrens in die Datenbank WAND (Web Assisted Notification of Devices) eingeben.
Geräte anderer Klassen
In Neuseeland müssen Sponsoren oder Lieferanten sicherstellen, dass Medizinprodukte Standards wie ISO 13485:2016 erfüllen. Die direkte Einreichung einer Konformitätserklärung, einer QMS-Zertifizierung oder eines Herstellungsnachweises bei Medsafe ist normalerweise nicht erforderlich. Die Aufbewahrung dieser Unterlagen ist jedoch entscheidend für den Nachweis der Konformität auf Anfrage.
Medsafe räumt der Überwachung nach dem Inverkehrbringen Vorrang vor der detaillierten Zulassung von Medizinprodukten vor dem Inverkehrbringen ein. Während Audits während der Notifizierungsphase nicht routinemäßig durchgeführt werden, kann Medsafe sie bei Produkten mit höherem Risiko oder nach Vigilanzaktivitäten und Berichten über unerwünschte Ereignisse einleiten, um kontinuierliche Sicherheit und Konformität zu gewährleisten.
Sobald ein Produkt über die WAND-Datenbank gemeldet ist, kann es in Neuseeland vermarktet werden, sofern der Lieferant die Medsafe-Vorschriften konsequent einhält. Dies erfordert eine kontinuierliche Einhaltung, insbesondere der Standards für die Überwachung nach dem Inverkehrbringen und die Meldung von Zwischenfällen. Die Experten für Medizinprodukte bei Freyr unterstützen die Unternehmen bei der Einhaltung dieser Vorschriften und stellen sicher, dass sie diese während des gesamten Produktlebenszyklus einhalten.
Prozessablauf
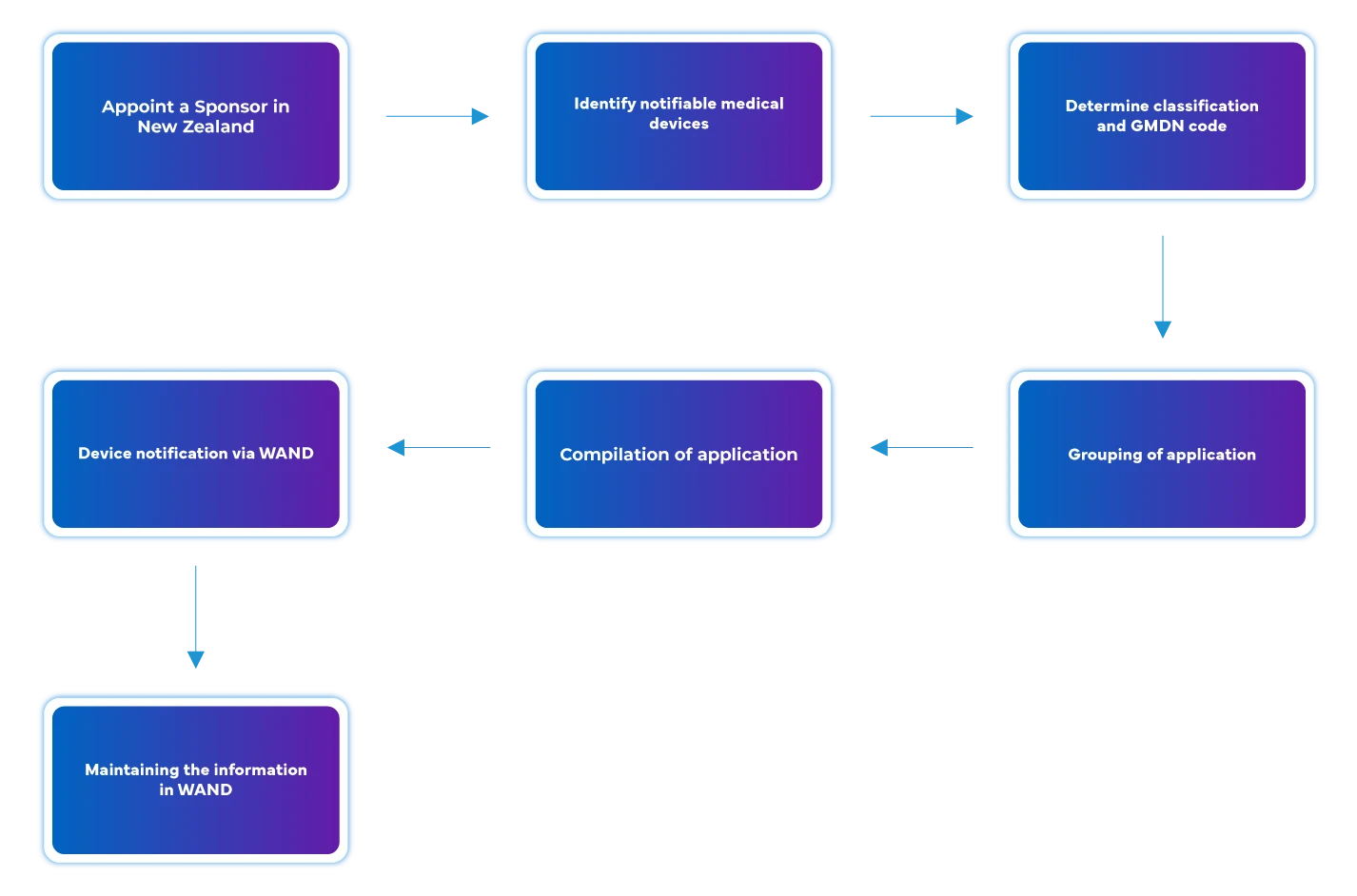
Management des Lebenszyklus von Geräten nach der Zulassung
Freyr unterstützt ausländische Hersteller beim end-to-end Lebenszyklusmanagement end-to-end , einschließlich Aktivitäten nach der Zulassung, indem es die neuseeländischen Behörden über WAND benachrichtigt, beispielsweise –
- Änderungsmanagement nach der Zulassung - Änderungen an bestehenden Zulassungen für Medizinprodukte, z. B. Hinzufügen neuer Varianten, Zubehörteile, neue Anwendungsgebiete usw.
- Aufrechterhaltung von Zulassungen und Registrierung.
Ausgestattet mit einem Team von Regulierungsexperten bietet Freyr den Herstellern umfassende Unterstützung bei der Einhaltung der für die Marktzulassung erforderlichen Qualitäts- und Sicherheitsstandards. Die Spezialisten des Unternehmens für regulatorische Informationen überwachen sorgfältig die Aktualisierungen der Vorschriften und stellen sicher, dass die Kunden gut über die notwendigen Maßnahmen zur Einhaltung der aktuellen Normen für ihre Produkte informiert sind.
Zusammenfassung
| Risiko | Geräteklasse | QMS-Audit | Regulierungspfad | Medsafe-Zeitpläne | Gültigkeitsdauer der Registrierung (Jahre) |
|---|---|---|---|---|---|
| Geringes Risiko | Klasse I Basic | Einhaltung der ISO 13485:2016 Hinweis: Medsafe schreibt keine QMS-Audits vor, empfiehlt jedoch dringend die Einhaltung der ISO 13485:2016 für Qualität und Sicherheit. Medsafe ist befugt, QMS-Audits für jede Geräteklasse durchzuführen, wenn Sicherheits- oder Qualitätsprobleme auftreten. | WAND Listing (Benachrichtigung) | 1 Woche |
Keine Verfallsdaten |
| Geringes Risiko | Messung der Klasse I | WAND Listing (Benachrichtigung) | |||
| Geringes Risiko | Klasse I steril | WAND Listing (Benachrichtigung) | |||
| Geringes bis mittleres Risiko | Klasse IIa | WAND Listing (Benachrichtigung) | |||
| Mittleres bis hohes Risiko | Klasse IIb | WAND Listing (Benachrichtigung) | |||
| Hohes Risiko | Klasse III | WAND Listing (Benachrichtigung) |
Hinweis: Nach der derzeitigen Gesetzgebung laufen die Produktlisten in Neuseeland nicht ab, aber Produkte, die ein unannehmbares Risiko für die Öffentlichkeit darstellen, können vom Markt genommen werden. Die derzeitige Gesetzgebung könnte jedoch bis 2026/2027 überarbeitet werden.
Freyr-Podcasts
- Unterstützung bei der Registrierung von Medizinprodukten von Anfang bis Ende.
- LR-Unterstützung
- WAND Auflistung
- Unterstützung bei der Etikettierung
- Änderungsmanagement nach der Genehmigung
- Lizenzübertragung
- Einreichung und Verbindungsdienste mit WAND
