Wissenschaftlicher Gültigkeitsbericht (SVR) Übersicht
Der wissenschaftliche Gültigkeitsbericht (SVR) ist ein wichtiger Bestandteil des Leistungsbewertungsberichts (PER) für In-vitro-Diagnostika (IVD) gemäß der Verordnung der Europäischen Union über In-vitro-Diagnostika (EU IVDR) 2017/746. Der SVR spielt eine entscheidende Rolle bei der wissenschaftlichen Validierung der analytischen und klinischen Leistung des Produkts und gewährleistet die Sicherheit und Wirksamkeit der auf dem Markt befindlichen Medizinprodukte. Im Rahmen des in der EU IVDR vorgeschriebenen Konformitätsbewertungsverfahrens müssen die Hersteller einer benannten Stelle eine PER vorlegen, die einen SVR enthalten muss, um die Sicherheit und Leistung des Produkts vor seiner Einführung auf dem EU-Markt nachzuweisen.
Wissenschaftliche Gültigkeitsberichte für den EU IVDR-Antrag
- Analyse und Schlussfolgerungen
Was ist der Inhalt des wissenschaftlichen Gültigkeitsberichts (SVR)?
Wissenschaftliche Validität eines Analyten bedeutet die Assoziation eines Analyten mit einem klinischen Zustand oder einem physiologischen Zustand. Die wissenschaftliche Validität eines IVD stützt sich hauptsächlich auf eine oder eine Kombination der folgenden Quellen:
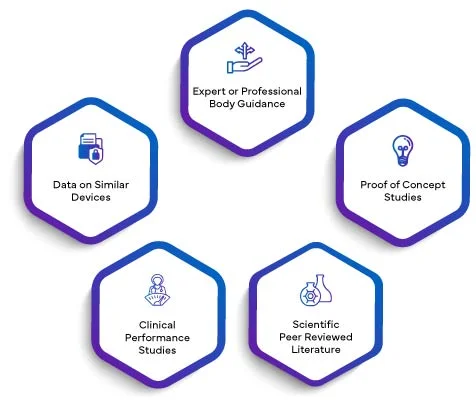
Die Daten aus allen oben genannten Bereichen werden in einem wissenschaftlichen Validitätsbericht zusammengefasst. Durch die Integration des SVR in die PER heben die Hersteller ihre Leistungsbewertung auf eine höhere Glaubwürdigkeitsstufe. Die wissenschaftliche Validität, die durch den SVR hergestellt wird, verleiht der PER eine solide Grundlage und erhöht ihre Gesamtqualität und Aussagekraft. Dies wiederum schafft Vertrauen bei Aufsichtsbehörden, medizinischen Fachkräften und Endanwendern und stellt sicher, dass die Leistung des IVD gemäß den strengen Anforderungen der EU IVDR 2017/746 sorgfältig bewertet und validiert wurde.
Freyr bietet umfassende Unterstützung bei der Erstellung eines soliden wissenschaftlichen Gültigkeitsberichts (SVR) für IVDs, damit Sie sich sicher in der behördlichen Landschaft bewegen und nahtlos sichere und wirksame IVD-Produkte auf den Markt bringen können.
Wissenschaftlicher Gültigkeitsbericht
- Übergangsplan für die Einhaltung der IVDR.
- Wissenschaftlicher Gültigkeitsbericht (SVR) auf der Grundlage von Literatur und/oder internen Daten.
- Klinische Leistungsberichte (CPR) auf der Grundlage von Literatur und/oder internen Daten.
- Analytische Leistungsberichte (APR)
- Klinische Nachweise oder Leistungsbewertungsberichte gemäß IVDR.
- Plan zur Leistungsbewertung.
- Post Market Performance Follow Up (PMPF) Protokolle und Berichte.
- Protokolle und Berichte der Post Market Surveillance (PMSR).
- Verfassen/Überarbeiten anderer Dokumente, wie Packungsbeilage/IFU, Kurzanleitung (QRI), Betriebs-/Benutzerhandbuch, usw.

- Sicherstellung der Einhaltung der jüngsten geltenden Vorschriften.
- Team von qualifizierten Experten
- Maßgeschneiderte Lösungen für Ihre Anforderungen
- Behördliches Ressourcenmanagement/Personalergänzungsdienste
- Funktionsübergreifende Beiträge von Experten für Medizinprodukte zur Erfüllung der Anforderungen.




