Überblick über die Registrierung von Software as a Medical Device SaMD)
Software als Medizinprodukt (SaMD), auch als Medizinprodukt-Software (MDSW) bezeichnet, ist das aktuellste Boomthema im Gesundheitswesen. Der weltweite SaMD wird bis 2027 auf einen Wert von US ,5 Milliarden US geschätzt, bei einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 21,9 % zwischen 2020 und 2027. Dieses Wachstum wird durch verschiedene Faktoren der SaMD ausgelöst, wie z. B. die Einführung des Internets der Dinge (IoT), digitale Gesundheitsplattformen und die Einführung von Software zur kontinuierlichen Überwachung physiologischer Parameter durch Gesundheitsdienstleister für die Fernbetreuung. Dies wurde durch die COVID-Pandemie weiter beschleunigt, die Fernbehandlungsdienste erforderlich machte und damit den Bedarf an einem optimierten Prozess für die Registrierung von Software als Medizinprodukt (SaMD) schuf. Es gibt drei Arten von Software im Zusammenhang mit Medizinprodukten, die auf der Klassifizierung von Software als Medizinprodukt (SaMD) basieren, darunter:
- Software in einem Medizinprodukt (SiMD)
- Software als MedizinproduktSaMD)
- Bei der Herstellung/Wartung eines Medizinprodukts verwendete Software
Globales Regulierungsszenario
In Bezug auf SaMDs werden verschiedene Arten für verschiedene Anwendungen eingesetzt, wie z. B. Screening und Diagnose, Überwachung und Alarmierung, Krankheitsmanagement usw. Die Gesundheitsbehörden von entwickelten oder stark regulierten Ländern wie der EU, den US, Kanada und Australien haben Vorschriften für SaMDs festgelegt, und einige von ihnen haben bereits Leitfäden entwickelt, während andere noch dabei sind. Einige halbregulierte und nicht regulierte Märkte betrachten solche Software als Medizinprodukte, verfügen jedoch nicht über differenzierte und spezifische Leitlinien für die Klassifizierung von Software als Medizinprodukt (SaMD). Sie folgen den international anerkannten harmonisierten Leitlinien für die Bewertung und Zulassung der Software. Nachstehend sind einige der wichtigsten Leitlinien zu SaMDs aufgeführt:
- IMDRF-Leitfaden für Klassifizierung, QMS, Bewertung der Cybersicherheit, klinische Bewertung
- Die EU MDR enthält detaillierte Informationen zu dieser Gerätekategorie
- MDCG-Leitfaden zur Qualifizierung und Klassifizierung von SaMD, CER / PER-Anforderungen für SaMD
- FDA US FDA zu Cybersicherheit, klinischer Bewertung und Registrierungsanforderungen für verschiedene Arten von Software, wie z. B. Entscheidungssysteme, PACS, mobile Anwendungen usw.
- Leitfaden Health Canada zur Definition und Klassifizierung
- Die neuen Vorschriften der TGA für softwarebasierte Medizinprodukte, die ab August 2020 in Kraft treten sollen
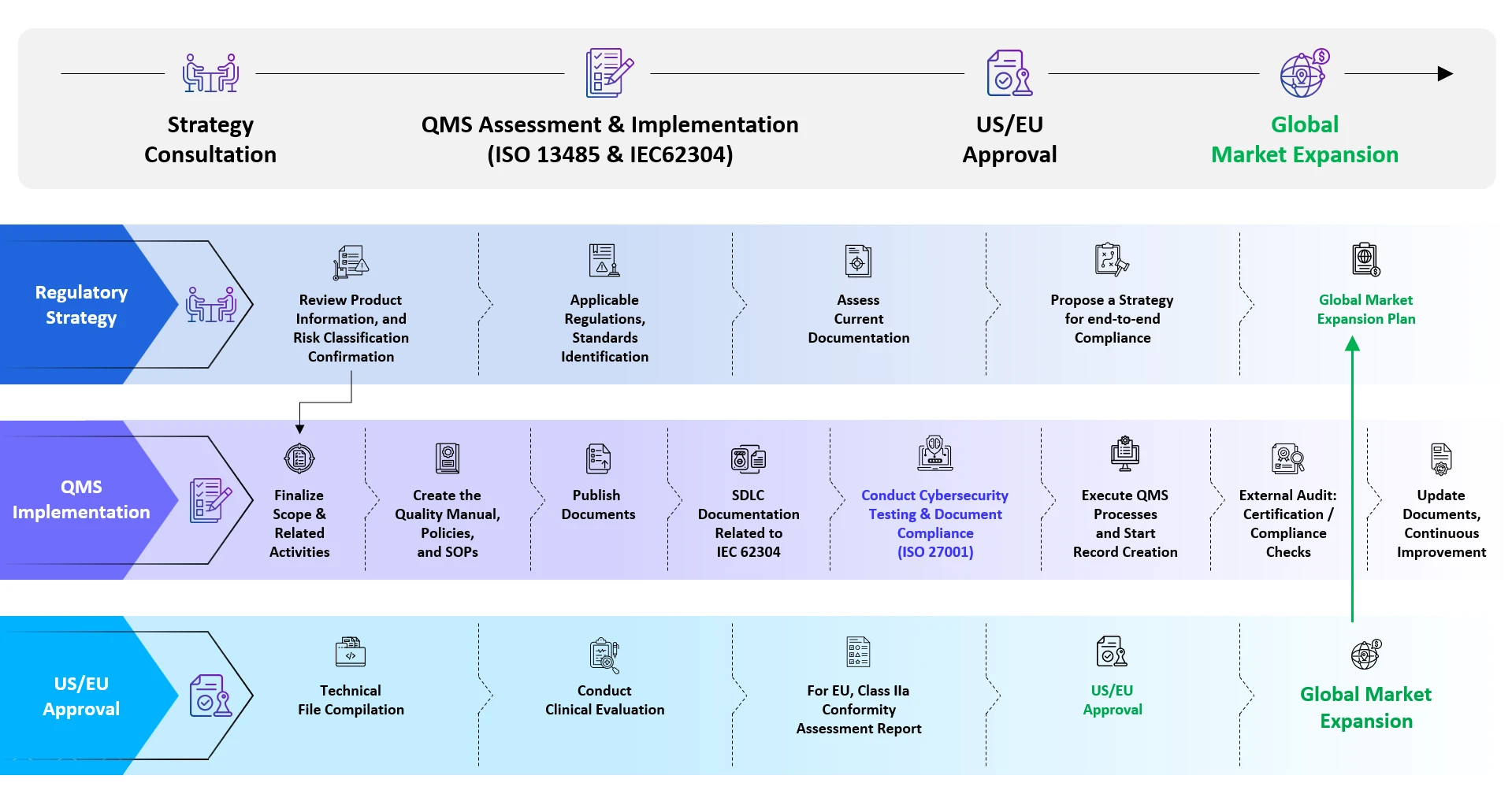
Die Zulassung von SaMD auf anderen globalen Märkten wird von Fall zu Fall gehandhabt und erfordert eine enge Interaktion mit der jeweiligen Gesundheitsbehörde für die Genehmigung. Der allgemeine Weg zur Registrierung von SaMD umfasst folgende Schritte:
- Feststellung, ob eine bestimmte Software als SaMD eingestuft werden kann
- Einstufung der Produkte nach dem jeweiligen Risiko
- Ermittlung der geltenden Normen und Datenanforderungen der betreffenden Gesundheitsbehörde
- Generierung von Daten gemäß den Anforderungen der jeweiligen Agentur
- Zusammenstellung der technischen Unterlagen gemäß den Anforderungen des Landes
- Einreichung und Beantwortung von Anfragen bis zur Genehmigung
- Management des Lebenszyklus nach der Zulassung
Freyr End-to-End Unterstützung für SaMD
Dienstleistungen zur Registrierung von Software as a Medical Device SaMD)
Registrierung von Software as a Medical Device SaMD) - Expertise
- Regulatory Intelligence Services
- Regulatorische Due Diligence / Strategieberichte
- Qualifizierung und Klassifizierung von SaMD
- Identifizierung der anwendbaren Normen
- Lückenanalyse der Quelldokumente
- SaMD
- Einhaltung des Quality Management System (QMS)
- Beratungsdienste für die Bewertung der Cybersicherheit
- Beratungsdienste für klinische Bewertungsstudien
- Zusammenstellung von klinischen Bewertungsberichten (CERs) / Produktbewertungsberichten (PERs) usw.
- Änderungsmanagement nach der Genehmigung