
Überblick über die Registrierung von Medizinprodukten in Taiwan
Taiwan hat eine wachsende Nachfrage nach Medizinprodukten. Die Taiwan Food & Drug Administration (TFDA), die dem Ministerium für Gesundheit und Wohlfahrt (MOHW) untersteht, reguliert Medizinprodukte durch das Pharmaceutical Affairs Act (PAA). Ausländische Hersteller, die keine Niederlassung in Taiwan haben, benötigen eine Vertretung in Taiwan als Voraussetzung für die Registrierung von Medizinprodukten in Taiwan.
Regulierungsbehörde: Taiwanische Lebensmittel- und Arzneimittelbehörde
Verordnung: Gesetz über pharmazeutische Angelegenheiten (PAA) und Verordnung über die Registrierung von Medizinprodukten
Bevollmächtigter Vertreter: Taiwan Agent Vertretung erforderlich
QMS-Anforderung: Dokumentation des Qualitätssystems (QSD) ISO 13485
Bewertung der technischen Datena: Abteilung für Medizinprodukte und Kosmetika
Gültigkeit der Lizenz: QSD - 3 Jahre; Produktregistrierung - 5 Jahre
Kennzeichnungsvorschriften: Artikel 75, Gesetz über pharmazeutische Angelegenheiten
Format der Einreichung: Papier
Sprache: Englisch und Chinesisch
Klassifizierung von Medizinprodukten in Taiwan
Die TFDA teilt Medizinprodukte je nach Risiko in 3 Klassen ein: Klasse I für Produkte mit geringem Risiko, Klasse II für Produkte mit mittlerem Risiko und Klasse III für Produkte mit hohem Risiko. Das Erfordernis eines Prädikats stellt eine Herausforderung für den Markteintritt neuartiger Produkte dar. Eine weitere Schwierigkeit besteht darin, dass für Produkte der Klassen II und III, die eine Dokumentation des Qualitätssystems erfordern, eine längere Verfahrensdauer erforderlich ist. Alle importierten Medizinprodukte müssen von der TFDA eine Registrierungsbescheinigung erhalten.
| Geräteklasse | Risiko |
|---|---|
| Klasse I | Geringes Risiko |
| Klasse II | Mäßiges Risiko |
| Klasse III | Hohes Risiko |
Vertretung für Taiwan
Ausländische Hersteller, die keine Niederlassung in Taiwan haben, sollten als Voraussetzung für die Vermarktung von Geräten in Taiwan einen Taiwan-Agenten ernennen. Die Ernennung eines Drittunternehmens als Taiwan-Agent anstelle eines Vertriebshändlers bietet die Flexibilität, mehrere Vertriebshändler für eine bessere Marktdurchdringung zu finden. Der Taiwan-Vertreter muss eine juristische Person mit Sitz in Taiwan sein, die über eine pharmazeutische Vertriebslizenz verfügt.
Registrierung von Medizinprodukten in Taiwan
Bevor ein Medizinprodukt in Taiwan verkauft werden kann, ist neben der Registrierung des Medizinprodukts auch eine Registrierung der Qualitätssystemdokumentation (QSD) für die Produktionsstätte erforderlich. Auf die QSD-Registrierung wird nur bei Medizinprodukten der Klasse I (nicht steril) verzichtet. Eine QSD-Lizenz (die nach Genehmigung der QSD-Registrierung erteilt wird) entspricht in Taiwan der Guten Herstellungspraxis (GMP) für Medizinprodukte.
Die TFDA kündigte an, dass ab dem 1. Juni 2022 die Lizenzinhaber von Medizinprodukten der Klasse III verpflichtet sind, die UDI und die entsprechenden Produktinformationen in die UDI-Datenbank (UDID) hochzuladen. Die Hersteller von Medizinprodukten sind außerdem verpflichtet, die UDI auf dem Produktetikett anzubringen. Darüber hinaus müssen Medizinprodukte der Klasse II ab dem 1. Juni 2023 die einschlägigen UDI-Vorschriften erfüllen.
Prozessablauf
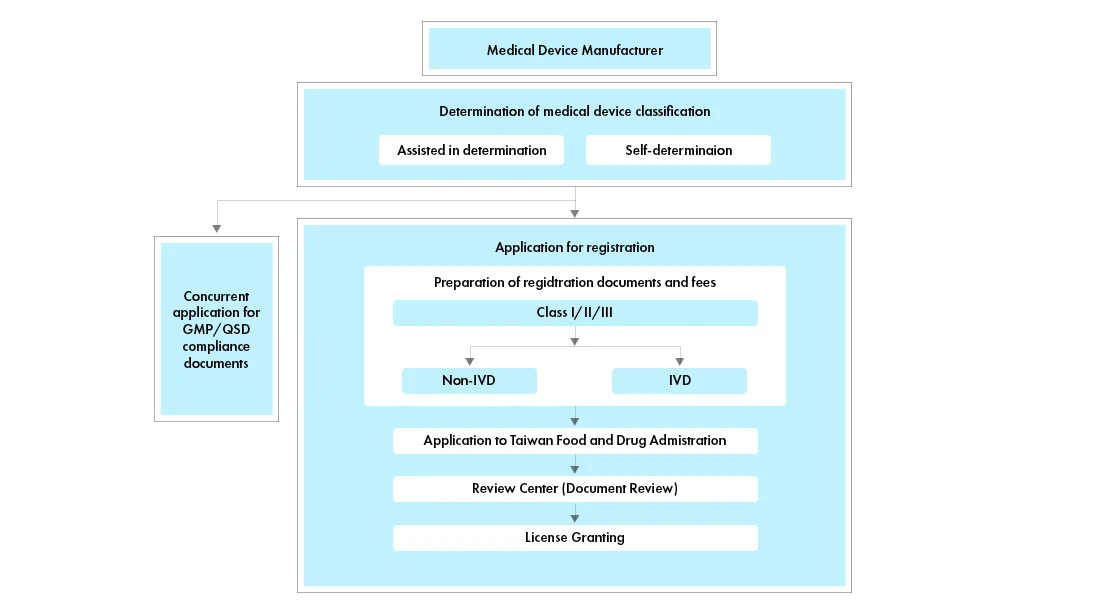
Management des Lebenszyklus von Medizinprodukten nach der Zulassung
Freyr ausländische Hersteller beim end-to-end Lebenszyklusmanagement end-to-end , einschließlich Aktivitäten nach der Zulassung, wie zum Beispiel:
- Änderungsmanagement nach der Zulassung - Änderungen bestehender Zulassungen für Medizinprodukte, z. B. Hinzufügung neuer Varianten und Zubehörteile, Hinzufügung neuer Anwendungsgebiete usw.
- Aufrechterhaltung von Zulassungen und Registrierung durch rechtzeitige Zahlung von Verwaltungs- und Registrierungsgebühren
- Erneuerung von Lizenzen
- Kontaktaufnahme zwischen der TFDA und dem Hersteller
- Verwaltung der Einfuhren
Freyr ist auf die Erfüllung der regulatorischen Anforderungen für Medizinprodukte in Taiwan spezialisiert. Mit seinem umfangreichen Netzwerk hilft Freyr bei der Ernennung eines zuverlässigen lokalen Vertreters, dessen Anwesenheit während der gesamten Überwachung nach der Markteinführung von größter Bedeutung ist. Unsere Experten helfen auch bei der Auswahl geeigneter Prädikatsprodukte und bestehender Zulassungen aus anderen Märkten, um den Markteintritt neuer Produkte zu unterstützen.
Zusammenfassung
| Geräteklasse | Risiko / Einstufungskriterien | QMS | Produktregistrierung |
|---|---|---|---|
| Klasse I | Geringes Risiko | Ausgenommen (nicht sterile Produkte der Klasse I) | Ja |
| Klasse II | Mäßiges Risiko | QSD | Ja |
| Klasse III | Hohes Risiko | QSD | Ja |
Freyr-Podcasts
- Regulatorische Due-Diligence-Prüfung
- Offizielle Klassifizierung
- QSD-Zulassungen
- Registrierung des Geräts
- Juristischer Vertreter
- Unterstützung bei der Etikettierung
- Unterstützung bei der Übersetzung
- Identifizierung und Qualifizierung von Händlern
- Post-Marketing-Überwachung
- Änderungsmanagement nach der Genehmigung
- Erneuerung und Übertragung von Lizenzen
- Einreichung und Kontaktaufnahme

