
Überblick über die Registrierung von Medizinprodukten in der Türkei
Der türkische Markt für Medizinprodukte hat in den letzten zehn Jahren ein erhebliches und stetiges Wachstum verzeichnet. Ab 2021 muss die Türkei bei der Registrierung von Medizinprodukten die EU-Verordnung über Medizinprodukte (MDR) 2017/745 und die Verordnung über In-vitro-Diagnostika (IVDR) 2017/746 einhalten. Dies hat den internationalen Handel gefördert und mehrere globale Unternehmen dazu veranlasst, ihre Medizinprodukte im Land auf den Markt zu bringen.
Regulierungsbehörde: Türkische Agentur für Arzneimittel und Medizinprodukte (TITCK)
Verordnung: Medizinprodukteverordnung (MDR) 2017/745, In-vitro-Diagnostika-Verordnung 2017/746
Regulierungspfad: Die CE-Kennzeichnung ist obligatorisch, gefolgt von der Registrierung/Notifizierung im Produktverfolgungssystem (UTS)
Türkei Lokaler Bevollmächtigter: Europäischer Bevollmächtigter (EAR) für ausländische (Nicht-EU/Nicht-Türkei) Hersteller
QMS-Anforderung: ISO 13485:2016
Bewertung der technischen Daten: Benannte Stelle für die CE-Kennzeichnung
Gültigkeit der Lizenz: Unbegrenzt
Format der Einreichung: Papier
Übersetzung: Übersetzte Dokumente in Türkisch
Klassifizierung der Geräte
Die Türkei folgt der gleichen Klassifizierung von Medizinprodukten, wie sie in der EU MDR und IVDR EU MDR festgelegt ist. Die Bestimmung der Produktklassifizierung kann eine Herausforderung sein, weshalb die Unterstützung durch einen erfahrenen Berater für Regulierungsfragen hier von entscheidender Bedeutung ist.
Medizinprodukt-Klassen -
| Klasse | Risiko |
|---|---|
| Klasse I | Niedrig |
| Klasse IIa | Mäßig |
| Klasse IIb | Mäßig bis hoch |
| Klasse III | Hoch |
In-vitro-Diagnostika-Klassen -
| Klasse | Risiko |
|---|---|
| Klasse A | Niedrig |
| Klasse B | Mäßig |
| Klasse C | Mäßig bis hoch |
| Klasse D | Hoch |
Türkei Örtlicher Bevollmächtigter
Aufgrund des Abkommens über die Zollunion müssen die EU-Hersteller nun keinen lokalen Bevollmächtigten mehr benennen, um ihre Geräte auf den Markt zu bringen.
Andere ausländische Hersteller müssen einen Europäischen Bevollmächtigten (EAR ) benennen, um die Produkte auf dem türkischen Markt in Verkehr zu bringen.
Registrierung von Medizinprodukten
Die CE-Kennzeichnung ist ein Konformitätsnachweis, den die Hersteller benötigen, um ihr Gerät in der Türkei auf den Markt zu bringen. Die CE-Kennzeichnung wird durch eine von der benannten Stelle durchgeführte Konformitätsbewertung vergeben. Die Türkei ist nun berechtigt, benannte Stellen gemäß der EU MDR und IVDR zu benennen.
Die Unternehmen müssen sich im zentralen Registrierungssystem (MERSIS) registrieren lassen und das Gerät im Produktverfolgungssystem (UTS) anmelden.
Prozessablauf
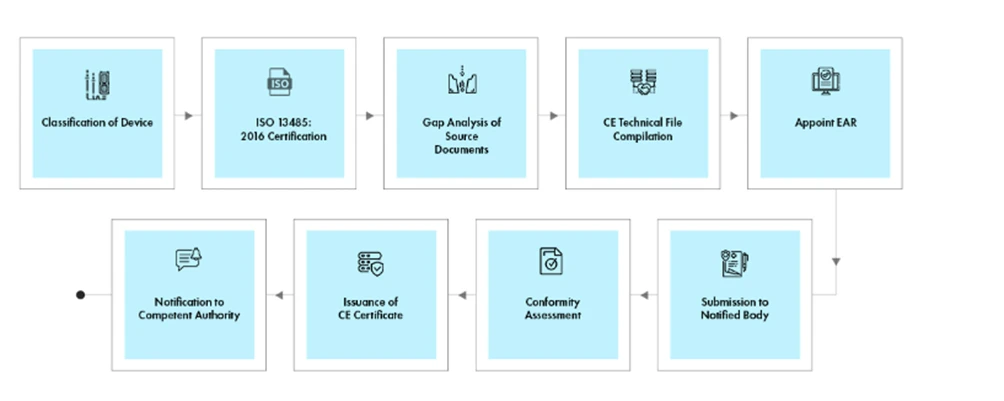
Management des Lebenszyklus von Geräten nach der Zulassung
Freyr ausländische Hersteller beim end-to-end Lebenszyklusmanagement end-to-end , einschließlich Aktivitäten nach der Zulassung, wie zum Beispiel:
- Änderungsmanagement nach der Zulassung - Änderungen bestehender Zulassungen für Medizinprodukte, z. B. Hinzufügung neuer Varianten und Zubehörteile, Hinzufügung neuer Anwendungsgebiete usw.
- Aufrechterhaltung der ISO 13485:2016- und CE-Zertifizierung
- Erneuerung von Lizenzen
- Verbindung zwischen der benannten Stelle und dem Hersteller
Da verschiedene Zulassungsbehörden beteiligt sind, müssen ausländische Hersteller bei jedem einzelnen Prozess zur Produktzulassung mehrere Vorschriften einhalten. Die Erlangung einer CE-Kennzeichnung und die Einhaltung der jeweiligen staatlichen Vorschriften erfordern umfassende Kenntnisse im Bereich der Regulierung. Ohne einen bewährten Partner im Bereich der Regulierung kann es für Marktneulinge manchmal schwierig sein, sich durch alle Produktanforderungen zu kämpfen. Um Hersteller zu unterstützen, Freyr end-to-end Dienstleistungen end-to-end Freyr , um die Zulassung von Medizinprodukten zu beschleunigen.
Freyr-Podcasts
- Europäische Klassifizierung von Medizinprodukten
- Unterstützung durch den Europäischen Bevollmächtigten (EAR)
- Türkei Produktregistrierung und Produktbenachrichtigung
- ISO 14971:2019 Beratung zum Risikomanagement
- Einhaltung der ISO 13485:2016
- Überprüfung, Zusammenstellung und Einreichung von technischen CE-Unterlagen/Geschmacksmusterdossiers
- EU MDR
- EU IVDR-Übergangsunterstützung
- Clinical Evaluation Reports (CER) für Medizinprodukte
- Leistungsbewertungsberichte (PER) für In-vitro-Diagnostika
- Notifizierung/Registrierung von Medizinprodukten über das Online-Registrierungssystem
- Strategiebericht zur Regulierung von Medizinprodukten
- Testunterstützung - Biokompatibilität, elektrische Sicherheit, Mechanik und Leistung
- Unterstützung bei der Einhaltung von Etikettierungsvorschriften
- GMP-Unterstützung
- Unterstützung der Überwachung nach der Markteinführung

