
Überblick über die Registrierung von Medizinprodukten in Vietnam
Der vietnamesische Markt für medizinische Geräte befindet sich im Aufschwung und ist derzeit einer der boomenden Sektoren des Landes. Medizinische Geräte werden in Vietnam von der Abteilung für medizinische Geräte und Gesundheitsarbeiten (DMEHW) des Gesundheitsministeriums reguliert. Ausländische Hersteller müssen einen lokalen autorisierten Vertreter in Vietnam ernennen, der sie bei der Registrierung von Medizinprodukten in Vietnam unterstützt.
Regulierungsbehörde: Abteilung für medizinische Ausrüstung und Gesundheitsarbeiten (DMEHW)
Verordnung: Dekret Nr. 98/2021/ CP
Bevollmächtigter Vertreter: Vietnam Bevollmächtigter Vertreter vor Ort
QMS-Anforderung: ISO 13485:2016
Bewertung der technischen Daten: Abteilung für medizinische Ausrüstung und Bauwesen (DMEC) des Gesundheitsministeriums
Labelling : Dekret Nr. 111/2021
Format der Einreichung: Online- Fristen: 15 - 60 Tage
Sprache: Englisch und Vietnamesisch
Vietnam Klassifizierung von Medizinprodukten
Die Geräte werden in 4 Klassen (A, B, C und D) eingeteilt, die wiederum in zwei Gruppen, Gruppe 1 (Klasse A) und Gruppe 2 (Klasse B, C und D), unterteilt werden. Die formale Klassifizierung ist beim vietnamesischen Department of Medical Equipment and Health Works (DMEHW) erhältlich.
| Gruppe | Klasse | Risiko |
|---|---|---|
Gruppe 1 | Klasse A | Niedriges Niveau |
Gruppe 2 | Klasse B | Geringeres durchschnittliches Risikoniveau |
Klasse C | Oberes Durchschnittsniveau der Risiken | |
Klasse D | Hoher Grad an Risiken |
Vietnam Bevollmächtigter Vertreter vor Ort
Die Ernennung eines zuverlässigen und fähigen vietnamesischen Vertreters für ausländische Hersteller ist von entscheidender Bedeutung, da dieser die vom Hersteller als Teil des Geräteverkaufs angebotenen Garantieleistungen übernehmen muss. Die Übersetzung in die vietnamesische Sprache ist ein Muss für den Markteintritt in der Region, was in der Praxis tatsächlich eine Herausforderung sein kann.
Freyr bietet regulatorische Unterstützung, die sich auf das gesamte Spektrum der Aktivitäten erstreckt, wie z. B. die Beschaffung der Freiverkaufs-Anerkennungsnummer für die Zulassung von Medizinprodukten bei den Behörden. Wir bieten auch sprachliche Unterstützung durch Experten, um die regulatorische Perspektive der Übersetzung aufrechtzuerhalten. Wir kümmern uns um die Bedürfnisse unserer Kunden nach der Zulassung, um die Konformität während des gesamten Produktlebenszyklus in Vietnam zu gewährleisten.
Vietnam Registrierung von Medizinprodukten
Für alle Produkte der Klassen A und B ist eine Marktzulassung (MA) erforderlich. Produkte der Klassen A und B werden von der Gesundheitsbehörde der Provinz, in der der Zulassungsinhaber ansässig ist, einer schnellen administrativen Prüfung unterzogen.
Geräte der Klassen C und D müssen nun eine Marktzulassung (MA) beantragen. Die MA-Lizenzen bleiben auf unbestimmte Zeit gültig.
Prozessablauf
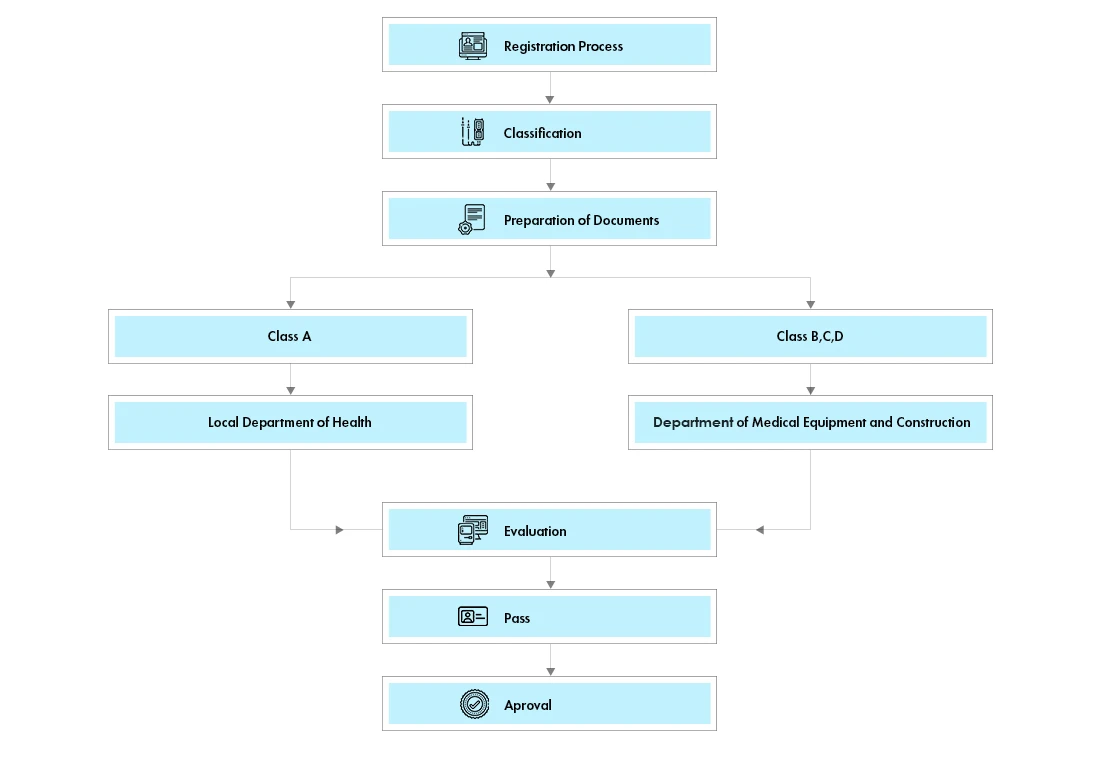
Management des Lebenszyklus von Geräten nach der Zulassung
Freyr ausländische Hersteller beim end-to-end Lebenszyklusmanagement end-to-end , einschließlich Aktivitäten nach der Zulassung, wie zum Beispiel:
- Änderungsmanagement nach der Zulassung - Änderungen bestehender Zulassungen für Medizinprodukte, z. B. Hinzufügung neuer Varianten und Zubehörteile, Hinzufügung neuer Anwendungsgebiete usw.
- Aufrechterhaltung von Zulassungen und Registrierung durch rechtzeitige Zahlung von Verwaltungs- und Registrierungsgebühren
- Erneuerung von Lizenzen
- Verbindung zwischen dem DMEHW und dem Hersteller
- Verwaltung der Einfuhren
Zusammenfassung
Gruppe | Klasse | Risiko | Regulierungspfad | Zeitleisten | Gültigkeit |
|---|---|---|---|---|---|
Gruppe 1 | Klasse A | Niedriges Niveau | Erklärung der anwendbaren Norm | 15 - 60 Tage | Unbegrenzt |
Gruppe 2 | Klasse B | Geringeres durchschnittliches Risikoniveau | Bescheinigung über die Anmeldung zum freien Verkauf | 15 - 60 Tage | 5 Jahre |
Klasse C | Oberes Durchschnittsniveau der Risiken | Bescheinigung über die Anmeldung zum freien Verkauf | 15 - 60 Tage | 5 Jahre | |
Klasse D | Hoher Grad an Risiken | Bescheinigung über die Anmeldung zum freien Verkauf | 15 - 60 Tage | 5 Jahre |
Freyr-Podcasts
- Regulatorische Due-Diligence-Prüfung
- Offizielle Klassifizierung
- Registrierung des Geräts
- Importlizenz
- Unterstützung bei der Etikettierung
- Unterstützung bei der Übersetzung
- Identifizierung und Qualifizierung von Händlern
- Post-Marketing-Überwachung
- Änderungsmanagement nach der Genehmigung
- Erneuerung und Übertragung von Lizenzen
- Einreichung und Kontaktaufnahme
- Zollabfertigung

