Häufig gestellte Fragen
Regulatory AffairsRA) in der pharmazeutischen Industrie bedeutet, die Qualität, Sicherheit und Wirksamkeit von Medikamenten während ihres gesamten Lebenszyklus sicherzustellen. RA navigieren durch die komplexen Anforderungen der globalen Gesundheitsbehörden und sorgen für die Einhaltung der Vorschriften von der Entdeckung bis zur Vermarktung von Arzneimitteln. Sie fungieren als Bindeglied zwischen den Pharmaunternehmen und den Zulassungsbehörden weltweit.
Der Hauptzweck der Regulierung in der Pharmaindustrie besteht darin, die öffentliche Gesundheit zu schützen, indem sichergestellt wird, dass neue Medikamente sicher und wirksam sind, bevor sie auf den Markt kommen. Die Aufsichtsbehörden setzen strenge Normen für Tests und Bewertungen durch, um mögliche Gesundheitsrisiken zu minimieren. Diese behördliche Aufsicht schafft Vertrauen in die medizinischen Behandlungen, die der Öffentlichkeit zur Verfügung stehen.
Fachleute für Zulassungsangelegenheiten stellen sicher, dass pharmazeutische Produkte während ihres gesamten Lebenszyklus den Zulassungsnormen entsprechen. Sie sind an der Planung klinischer Studien, der Marktzulassung und der Verwaltung nach der Zulassung beteiligt, sorgen für die laufende Einhaltung der Vorschriften und erleichtern notwendige Produktänderungen. Ihr Fachwissen hilft Unternehmen, sichere und wirksame Produkte effizient auf den Markt zu bringen.
Das Lebenszyklusmanagement in der Pharmazie umfasst die Aufrechterhaltung der Lebensfähigkeit eines Produkts von der Entwicklung bis zur Nachzulassung. Es umfasst Strategien für die klinische Entwicklung, die Marktzulassung und die kontinuierliche Einhaltung der Zulassungsstandards. Ein wirksames Lebenszyklusmanagement gewährleistet, dass das Produkt während seiner gesamten Marktpräsenz sicher und wirksam bleibt.
Die Arzneimittelregulierung hat sich erheblich weiterentwickelt, von mittelalterlichen Arzneimittellisten bis hin zu modernen internationalen Harmonisierungsbemühungen. Zu den wichtigsten Meilensteinen zählen der US Food and Drugs Act von 1906 und die Gründung der International Conference on Harmonization (ICH) im Jahr 1990. Diese Entwicklungen haben die globalen Standards für die Sicherheit und Wirksamkeit von Arzneimitteln gestärkt.
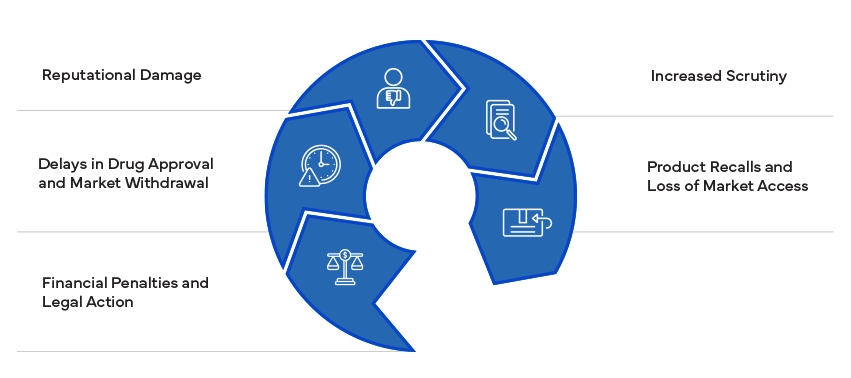
Die Nichteinhaltung behördlicher Vorschriften kann erhebliche Konsequenzen nach sich ziehen, darunter Geldstrafen, Rechtsstreitigkeiten und die Rücknahme von Produkten. Sie kann den Ruf eines Unternehmens schädigen und zu einer verstärkten Kontrolle durch die Aufsichtsbehörden führen. Um diese Risiken zu vermeiden und den Marktzugang aufrechtzuerhalten, muss die Einhaltung der Vorschriften gewährleistet sein.
Freyr bietet umfassende Lösungen im Bereich Regulierung an und unterstützt seine Kunden von der frühen Entwicklungsphase bis hin zur Kommerzialisierung. Zu den Dienstleistungen von Freyr gehören die Erstellung von Unterlagen für die Gesundheitsbehörden, die Identifizierung von regulatorischen Herausforderungen und die Beratung zu Strategien nach der Markteinführung. Das Fachwissen von Freyr trägt dazu bei, die Produktentwicklung und Marktverfügbarkeit zu beschleunigen.
Die globale Harmonisierung der Rechtsvorschriften zielt darauf ab, die Entwicklung und Zulassung von Arzneimitteln in verschiedenen Ländern zu rationalisieren. Sie minimiert Tierversuche und gewährleistet die öffentliche Gesundheit durch die internationale Angleichung der regulatorischen Anforderungen. Diese Harmonisierung erleichtert die effiziente Einführung neuer Behandlungen auf den globalen Märkten.
Zulassungsbehörden wie die FDA in den Vereinigten Staaten und die EMA in der Europäischen Union setzen Standards durch, um die Sicherheit und Wirksamkeit von Arzneimitteln zu gewährleisten. Sie beaufsichtigen umfassende Test- und Bewertungsverfahren, bevor Medikamente auf den Markt gebracht werden können. Diese Behörden sorgen für ein Gleichgewicht zwischen dem Bedarf an neuen Behandlungen und der Minimierung möglicher Gesundheitsrisiken.
Das Global Regulatory intelligence Framework von Freyr bietet aktuelle Informationen über globale Vorschriften und den Stand der Gesundheitsbehörden. Dieser Rahmen wird in Kundenprojekte integriert, um den marktspezifischen Erfolg zu verbessern. Es unterstützt die strategische Planung und die Einhaltung gesetzlicher Vorschriften in verschiedenen Regionen.