Konforme Artwork für pharmazeutische Artwork
Sicherstellung konformer und wirkungsvoller artwork für Arzneimittel artwork Konzept bis zur Markteinführung.
Themen durchsuchen
- Was sind regulatorische Artwork ?
- Was sind die wichtigsten Komponenten von artwork im Bereich Regulatory artwork ?
- Welche Bedeutung hat die Einhaltung von Vorschriften in der pharmazeutischen Industrie?
- Übersicht über die regulatorischen Anforderungen für Artwork der Pharmabranche
- Welche Auswirkungen haben technologische Fortschritte auf die Regulierung Artwork?
- Globale Aufsichtsbehörden und Richtlinien
- Was sind die wichtigsten Vorschriften und Standards für pharmazeutische Artwork?
- Welche Auswirkungen hat die Nichteinhaltung von Vorschriften Artwork?
- Was sind die Herausforderungen im Bereich Artwork sich Pharmaunternehmen stellen müssen?
- Wie geht Ihr Team mit Artwork um?
- Was sind die Anzeichen dafür, dass Ihr Unternehmen einen Dienstleister Artwork benötigt?
- Was sind die Vorteile einer Partnerschaft mit einem Artwork ?
- Wie kann Freyr Sie weltweit unterstützen?
- Warum Freyr?
- Unsere Dienstleistungen
Was sind regulatorische Artwork ?
Zuletzt aktualisiert am: September, 2024
Im stark regulierten Bereich der Pharmazeutika spielen regulatorische artwork eine zentrale Rolle bei der Erstellung, Verwaltung und Einreichung von artwork den strengen regulatorischen Standards entsprechen. Diese Dienstleistungen umfassen eine Reihe spezialisierter Lösungen, die darauf abzielen, die Einhaltung globaler Vorschriften und Standards für Etiketten, Verpackungen und andere Druckerzeugnisse im Zusammenhang mit pharmazeutischen Produkten zu gewährleisten. Durch die Bereitstellung von Fachwissen in artwork , Einhaltung von Kennzeichnungsvorschriften, Lokalisierung, Übersetzung, regulatorische Informationen, artwork und Qualitätssicherung sind regulatorische artwork für Pharmaunternehmen, die sich effizient in der komplexen regulatorischen Landschaft zurechtfinden wollen, unverzichtbar. Ihre akribische Liebe zum Detail gewährleistet die Sicherheit der Patienten, fördert die Einhaltung von Vorschriften und erleichtert den nahtlosen Markteintritt von pharmazeutischen Produkten.
Darüber hinaus bieten artwork regulatorischen artwork Pharmaunternehmen in einem Umfeld, in dem sich die regulatorischen Anforderungen ständig weiterentwickeln, kontinuierliche Unterstützung und Beratung. Durch die ständige Aktualisierung der regulatorischen Anforderungen und die Anwendung bewährter Verfahren stellen diese Dienstleistungen sicher, dass die Verpackung und Kennzeichnung von Arzneimitteln den neuesten Vorschriften entspricht, wodurch Risiken gemindert und die Produktintegrität während des gesamten Lebenszyklus gewährleistet wird.

Was sind die wichtigsten Komponenten von artwork im Bereich Regulatory artwork ?
Die wichtigsten Komponenten artwork regulatorischen artwork tragen gemeinsam dazu bei, die Einhaltung der regulatorischen Anforderungen sicherzustellen, die Qualität und Wirksamkeit der pharmazeutischen Verpackungen und Kennzeichnungen zu verbessern und die Gesundheit und Sicherheit der Patienten zu gewährleisten.
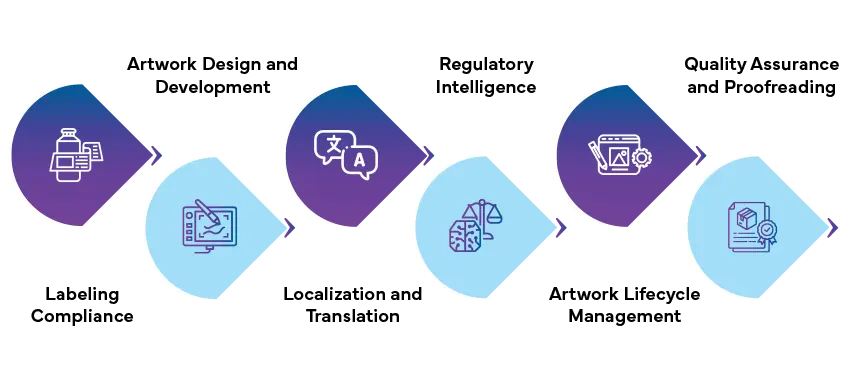
Einhaltung der Etikettierungsvorschriften
- Sicherstellung, dass die Produktetiketten korrekte und konforme Informationen gemäß den gesetzlichen Anforderungen enthalten.
- Überprüfung und Verifizierung des Inhalts von Etiketten auf Richtigkeit, Vollständigkeit und Einhaltung der regulatorischen Richtlinien.
- Leitfaden für die Gestaltung, das Format, die Schriftgröße und die Symbole von Etiketten, um die Einhaltung der Vorschriften und die Lesbarkeit zu gewährleisten.
Artwork und Entwicklung
- Zusammenarbeit mit Grafikdesignern und Regulierungsexperten, um artwork zu erstellen, artwork den regulatorischen Anforderungen entsprechen und gleichzeitig die Markenidentität bewahren.
- Entwicklung von Verpackungsdesigns, die dem Endverbraucher wesentliche Informationen, einschließlich Dosierungsanweisungen, Warnhinweise und Vorsichtsmaßnahmen, wirksam vermitteln.
- Einbindung von Symbolen, Symbolen und Warnhinweisen gemäß den behördlichen Richtlinien.
Lokalisierung und Übersetzung
- Anpassung von artwork Beschriftungen für verschiedene Märkte und Sprachen, um den regionalen gesetzlichen Anforderungen zu entsprechen.
- Genaue Übersetzung von Beschriftungsinhalten unter Gewährleistung der sprachlichen und kulturellen Angemessenheit.
- Durchführung von linguistischen Validierungs- und Qualitätssicherungsprüfungen, um die Genauigkeit und Konsistenz der übersetzten Inhalte zu überprüfen.
Regulatorische Intelligenz
- Überwachung von regulatorischen Änderungen und Aktualisierungen, die sich auf artwork auswirken können.
- Bereitstellung aktueller Einblicke und Leitlinien zu sich entwickelnden Regulierungsstandards und -richtlinien.
- Unterstützung von Pharmaunternehmen bei der Navigation durch komplexe regulatorische Landschaften und der Anpassung artwork regulatorische Änderungen.
Artwork
- Verwaltung des gesamten artwork , von der Konzeptentwicklung bis zur endgültigen Freigabe und Produktion.
- Implementierung von Änderungskontrollprozessen zur Verfolgung und Verwaltung von artwork und Aktualisierungen artwork .
- Gewährleistung von Konsistenz, Genauigkeit und Konformität über alle artwork und Iterationen artwork hinweg.
Qualitätssicherung und Lektorat
- Durchführung von Qualitätssicherungs- und Korrekturleseprüfungen zur Ermittlung von Fehlern, Unstimmigkeiten und Abweichungen von den gesetzlichen Anforderungen.
- Implementierung strenger Qualitätskontrollprozesse, um sicherzustellen, dass artwork den höchsten Standards in Bezug auf Qualität und Genauigkeit artwork .
- Empfehlungen und Korrekturmaßnahmen zur Behebung festgestellter Probleme und zur Verbesserung artwork .
Welche Bedeutung hat die Einhaltung von Vorschriften in der pharmazeutischen Industrie?
Die Einhaltung von Vorschriften im Pharmasektor bezieht sich auf die Einhaltung der von den Aufsichtsbehörden der Branche erlassenen Vorschriften und Gesetze. Dazu gehört ein umfassendes Verständnis der einschlägigen Gesetze und Vorschriften, die auf die eigene Geschäftstätigkeit anwendbar sind, gefolgt von einer akribischen Einhaltung dieser Vorschriften, um potenzielle Strafen oder rechtliche Konsequenzen zu vermeiden. Im pharmazeutischen Bereich umfasst die Einhaltung von Vorschriften verschiedene Aspekte, die von der Gewährleistung der Produktsicherheit bis zur Einhaltung ethischer Marketingpraktiken reichen.
Die Bedeutung der Einhaltung von Rechtsvorschriften kann gar nicht hoch genug eingeschätzt werden, da sie als Schutzmaßnahme dienen, um die Verbraucher vor potenziellen Gefahren im Zusammenhang mit Produkten oder Dienstleistungen zu schützen und gleichzeitig das rechtmäßige Verhalten von Unternehmen zu gewährleisten. Die Nichteinhaltung von Vorschriften hat erhebliche Konsequenzen, darunter hohe Geldstrafen und in schweren Fällen auch strafrechtliche Konsequenzen. Daher müssen Pharmaunternehmen die Compliance-Standards gewissenhaft einhalten, um solche negativen Folgen zu vermeiden.
Die kontinuierliche Einhaltung der Vorschriften erfordert einen proaktiven Ansatz, der eine ständige Wachsamkeit in Bezug auf Entwicklungen in der Branche und Aktualisierungen der Rechtsvorschriften voraussetzt. Dies erfordert eine häufige Überwachung der maßgeblichen Regierungsplattformen im Hinblick auf Gesetzesänderungen und das Abonnieren einschlägiger Publikationen, um Einblicke in die Änderungen der Vorschriften zu erhalten. Darüber hinaus ist ein gründliches Verständnis der organisatorischen Verpflichtungen im Rahmen der geltenden Gesetze unabdingbar, um eine umfassende Compliance-Strategie zu formulieren und umzusetzen und so die nachhaltige Einhaltung der gesetzlichen Vorschriften zu gewährleisten.
Übersicht über die regulatorischen Anforderungen für Artwork der Pharmabranche
Im Pharmasektor artwork die Einhaltung der behördlichen Vorschriften hinsichtlich artwork von entscheidender Bedeutung, um die wirksame und sichere Verwendung von Arzneimitteln zu gewährleisten und gleichzeitig die gesetzlichen Anforderungen zu erfüllen. Diese Anforderungen umfassen eine Vielzahl von Richtlinien und Normen, die die Konzeption, den Inhalt und die Darstellung von pharmazeutischen Verpackungen und Etiketten regeln.
In erster Linie artwork pharmazeutische artwork den Vorschriften der zuständigen Gesundheitsbehörden entsprechen, wie beispielsweise der Food and Drug Administration (FDA in den Vereinigten Staaten, der Europäischen Arzneimittelagentur (EMA) in Europa und ähnlichen Einrichtungen weltweit. Diese Vorschriften verlangen die Angabe wichtiger Informationen auf Verpackungen und Etiketten, darunter Produktidentifikation, Dosierungsanweisungen, Warnhinweise, Kontraindikationen und Verfallsdaten.
Darüber hinaus ist die Einhaltung spezifischer Formatierungs- und Designprotokolle unerlässlich, um Kohärenz, Lesbarkeit und Einheitlichkeit über verschiedene Verpackungsformate und -größen hinweg zu gewährleisten. Dies erfordert die Einhaltung von Kriterien in Bezug auf die Schriftgröße, die farbliche Differenzierung und die strategische Platzierung wichtiger Details, um die Klarheit zu optimieren und die Wahrscheinlichkeit von Medikationsfehlern zu verringern.
Darüber hinaus sind strenge Qualitätssicherungsmaßnahmen erforderlich, um die Genauigkeit, Vollständigkeit und Einhaltung der Vorschriften von pharmazeutischen artwork zu überprüfen, artwork diese zur Umsetzung freigegeben werden. Dies umfasst in der Regel umfassende Bewertungen durch Spezialisten für regulatorische Angelegenheiten, Qualitätssicherungsexperten und gelegentlich auch externe Berater für regulatorische Angelegenheiten, um Abweichungen oder Nichtkonformitäten zu identifizieren und zu beheben.
Zusammenfassend lässt sich sagen, dass die Einhaltung der behördlichen Vorschriften für pharmazeutische artwork unerlässlich artwork , um das Wohl der Patienten zu gewährleisten, die Wirksamkeit der Produkte zu erhalten und die mit der Nichteinhaltung verbundenen rechtlichen und regulatorischen Risiken zu mindern. Pharmaunternehmen müssen die sich weiterentwickelnden regulatorischen Rahmenbedingungen aufmerksam beobachten und ihre artwork kontinuierlich verfeinern, um die Einhaltung der Vorschriften zu gewährleisten und unvergleichliche Qualitäts- und Sicherheitsstandards für ihre Produkte aufrechtzuerhalten.
Welche Auswirkungen haben technologische Fortschritte auf die Regulierung Artwork?
artwork regulatorischen artwork hat aufgrund des kontinuierlichen technologischen Fortschritts einen tiefgreifenden Wandel erfahren. Diese Fortschritte haben nicht nur die Abläufe rationalisiert, sondern auch die Präzision, Wirksamkeit und Einhaltung regulatorischer Standards im pharmazeutischen Bereich verbessert.
Hier finden Sie eine eingehende Untersuchung des Einflusses der Technologie auf regulatorische artwork:
Verbesserte Betriebseffizienz und Prozessoptimierung
- Einsatz von Software Artwork und Verwaltung Artwork : Spezielle Softwaretools haben manuelle Methoden abgelöst und ermöglichen eine effiziente Entwicklung, Änderung und Versionskontrolle von artwork.
- Umstellung auf elektronische Einreichungen: Die weit verbreitete Einführung elektronischer Einreichungssysteme durch die Regulierungsbehörden hat die Abhängigkeit von papierbasierten Unterlagen beseitigt und damit die Genehmigungsverfahren beschleunigt.
- Integration von Kollaborationsplattformen: Online-Plattformen dienen als Kanäle für eine nahtlose Zusammenarbeit zwischen den Beteiligten, fördern eine bessere Kommunikation und straffen die Prüfungs- und Genehmigungsverfahren.
Verbesserte Präzision und Datenintegrität
- Automatisierte Dateneingabemechanismen: Die Integration mit Unternehmenssystemen wie Product Information Management (PIM) reduziert manuelle Dateneingabefehler und gewährleistet Einheitlichkeit bei allen artwork .
- Einsatz digitaler Signaturen und Prüfpfade: Elektronische Signaturfunktionen und umfassende Prüfpfade stärken die Datenintegrität und Rückverfolgbarkeit während des gesamten artwork .
- Einsatz von Validierungstools: Automatisierte Validierungstools identifizieren potenzielle Unstimmigkeiten im artwork und mindern so das Risiko von Verstößen gegen Vorschriften.
Verbesserte Zugänglichkeit zu globalen Märkten und Harmonisierungsinitiativen
- Einführung von Übersetzungsmanagementsystemen: Softwarelösungen beschleunigen die Übersetzung und Lokalisierung von artwork verschiedene globale Märkte, gewährleisten die Einhaltung gesetzlicher Vorschriften und sind auf unterschiedliche Patientengruppen zugeschnitten.
- Zugang zu Datenbanken mit regulatorischen Informationen: Online-Repositories ermöglichen den Zugriff auf gesetzliche Bestimmungen und Leitfäden aus verschiedenen Ländern und erleichtern so die Einhaltung von Vorschriften auf globaler Ebene.
- Förderung von Harmonisierungsinitiativen: Die Zusammenarbeit zwischen Regulierungsbehörden fördert die Angleichung der Kennzeichnungsanforderungen und vereinfacht artwork für internationale Märkte.
Erforschung aufstrebender Technologien
- Integration künstlicher Intelligenz (KI): KI-gestützte Lösungen analysieren artwork Konformitätsabweichungen, automatisieren sich wiederholende Aufgaben und personalisieren Patienteninformationen für ein höheres Engagement.
- Einführung von Augmented Reality (AR): Die AR-Technologie überlagert interaktive Informationen auf der Verpackung und versorgt die Patienten mit zusätzlichen Produktdetails und Anwendungshinweisen.
- Nutzung der Blockchain: Die Blockchain-Technologie verbessert die Datensicherheit und Rückverfolgbarkeit über den gesamten artwork hinweg und fördert so Vertrauen und Transparenz innerhalb des regulatorischen Rahmens.
Diese technologischen Fortschritte haben artwork regulatorischen artwork tiefgreifend beeinflusst und den Weg für eine effizientere, genauere und weltweit zugängliche Landschaft geebnet. Durch die Nutzung dieser Innovationen und die proaktive Bewältigung der damit verbundenen Herausforderungen können Unternehmen die Einhaltung von Vorschriften, die Wirksamkeit und die Reaktionsfähigkeit auf die sich wandelnden Anforderungen von Patienten und Aufsichtsbehörden im dynamischen Pharmasektor gewährleisten.
Globale Aufsichtsbehörden und Richtlinien
Die Navigation durch das komplexe Feld der weltweiten Vorschriften für pharmazeutische artwork eine enorme Herausforderung artwork . In diesem Abschnitt werden wichtige Aufsichtsbehörden und ihre entsprechenden Richtlinien näher beleuchtet, um Ihnen wichtige Einblicke zu vermitteln:
Die Navigation durch das komplexe Feld der weltweiten Vorschriften für pharmazeutische artwork eine enorme Herausforderung artwork . In diesem Abschnitt werden wichtige Aufsichtsbehörden und ihre entsprechenden Richtlinien näher beleuchtet, um Ihnen wichtige Einblicke zu vermitteln:
Lebensmittel- und Arzneimittelbehörde der Vereinigten StaatenFDA)
Behörde: Die FDA überwacht die Kennzeichnung und Verpackung von Human- und Tierarzneimitteln in den Vereinigten Staaten.
Wichtige Leitlinien:
- Code of Federal Regulations (CFR) Titel 21, Teile 201 und 601: In diesen Abschnitten werden die Anforderungen an die Kennzeichnung von Arzneimitteln und biologischen Produkten beschrieben.
- Leitfaden für die Industrie: Kennzeichnung von verschreibungspflichtigen und rezeptfreien Arzneimitteln: Dieses Dokument enthält umfassende Empfehlungen zu Inhalt, Format und Aufmachung der Etiketten.
- Leitlinien des Internationalen Rates zur Harmonisierung der technischen Anforderungen an HumanarzneimittelICH): Die FDA übernimmt häufig einschlägige ICH zu Kennzeichnungsstandards und verweist darauf.
Europäische ArzneimittelbehördeEMA)
Behörde: Die EMA für die Zulassung und Überwachung von Human- und Tierarzneimitteln in der gesamten Europäischen Union (EU) zuständig.
Wichtige Leitlinien:
- Verordnung (EG) Nr. 726/2004 der Kommission: Diese Verordnung legt die Kennzeichnungsvorschriften für Humanarzneimittel innerhalb der EU fest.
- Leitlinie zur Labelling Humanarzneimitteln: Diese Richtlinie enthält umfassende Leitlinien zum Inhalt, Format und zur Darstellung von Etiketten.
- ICH : Analog zur FDA übernimmt und verweist die EMA auf einschlägige ICH zu Kennzeichnungsprotokollen.
WeltgesundheitsorganisationWHO)
Behörde: Die WHO übernimmt eine globale Führungsrolle und bietet Orientierungshilfen für pharmazeutische Vorschriften und strebt eine weltweite Harmonisierung und Standardisierung an.
Wichtige Leitlinien:
- Anhang 9 der WHO für die Gute Herstellungspraxis (GMP): Dieser Anhang enthält Empfehlungen für die Kennzeichnung und Verpackung pharmazeutischer Produkte.
- WHO für unentbehrliche Arzneimittel: In diesen Listen werden die wichtigsten Medikamente für verschiedene Bereiche der Gesundheitsfürsorge empfohlen, oft zusammen mit spezifischen Etikettierungsvorschriften.
Internationaler Rat für HarmonisierungICH)
Rolle: ICH ist eine globale Initiative, an der Regulierungsbehörden aus Europa, Japan, den Vereinigten Staaten und anderen Regionen beteiligt sind.
Leitlinien: ICH formuliert harmonisierte Leitlinien für verschiedene Bereiche der pharmazeutischen Entwicklung, einschließlich der Kennzeichnungsprotokolle.
ICH Q3C: Diese Leitlinie enthält Empfehlungen für die Entwicklung und Begründung von Etikettierungen und Packungsbeilagen für Humanarzneimittel.
Andere regionale Aufsichtsbehörden
Mehrere regionale Aufsichtsbehörden veröffentlichen ihre spezifischen Richtlinien für pharmazeutische artwork, die häufig mit den von den Behörden festgelegten Grundsätzen übereinstimmen oder auf diese verweisen. Bemerkenswerte Beispiele hierfür sind:
- Nationale Behörde für MedizinprodukteNMPA)
- Japanische Agentur für Arzneimittel und MedizinproduktePMDA)
- Health Canada
Was sind die wichtigsten Vorschriften und Standards für pharmazeutische Artwork?
Für pharmazeutische artwork gelten strenge Vorschriften und Normen, artwork die Einhaltung der behördlichen Anforderungen zu gewährleisten und die Patientensicherheit zu fördern. Hier sind die wichtigsten Vorschriften und Normen für pharmazeutische artwork:
FDA (Vereinigte Staaten)
- Code of Federal Regulations (CFR) Titel 21, Teile 201 und 314: Legt die Anforderungen an die Kennzeichnung von verschreibungspflichtigen und rezeptfreien Medikamenten fest, einschließlich Spezifikationen für Inhalt, Format und Platzierung von Informationen auf Etiketten und Verpackungen.
EMA (Europäische Union)
- Verordnung (EG) Nr. 726/2004 der Kommission: Legt die Kennzeichnungsvorschriften für Humanarzneimittel in der EU fest, darunter Aspekte wie Inhalt, Darstellung und sprachliche Anforderungen.
- Leitfaden zur Labelling Humanarzneimitteln: Enthält detaillierte Leitlinien zum Inhalt und Format von Etiketten, einschließlich Anforderungen an die Lesbarkeit und Verständlichkeit.
ICH
- ICH (Qualität biotechnologischer Produkte: Stabilitätsprüfung biotechnologischer/biologischer Produkte): Enthält Leitlinien für die Gestaltung und den Inhalt von Packungsbeilagen für biotechnologische Produkte, einschließlich Überlegungen zur artwork
- ICH (R2) Pharmazeutische Entwicklung: Bietet Grundsätze für die pharmazeutische Entwicklung, einschließlich Überlegungen zur Kennzeichnung und artwork des gesamten Produktlebenszyklus.
ISO-Normen
- ISO 11607 (Verpackung für in der Endphase sterilisierte Medizinprodukte): Legt Anforderungen an die Gestaltung, Validierung und Kennzeichnung von Verpackungen für in letzter Instanz sterilisierte Medizinprodukte fest, die Sicherheit und Wirksamkeit gewährleisten.
- ISO 13485 (Medizinprodukte - Qualitätsmanagementsysteme): Legt Anforderungen an Qualitätsmanagementsysteme für die Entwicklung und Herstellung von Medizinprodukten fest, einschließlich Überlegungen zur Kennzeichnung.
Pharmakopöische Normen
- Pharmakopöe der Vereinigten Staaten (USP): Enthält Normen für die Kennzeichnung, Verpackung und Lagerung von Arzneimitteln, die die Qualität und Sicherheit der Produkte gewährleisten.
- Europäische Pharmakopöe (Ph. Eur.): Enthält Monographien und Richtlinien für die Kennzeichnung und Verpackung von Arzneimitteln, die die Einhaltung der gesetzlichen Vorschriften in Europa gewährleisten.
Leitlinien der guten Herstellungspraxis (GMP)
- FDA (21 CFR Teil 210 und 211): Legen die Anforderungen für die Herstellung, Etikettierung und Verpackung von pharmazeutischen Produkten fest, um Qualität und Sicherheit zu gewährleisten.
- EU-GMP-Leitfaden: Umriss der Grundsätze und Richtlinien für die pharmazeutische Herstellung, einschließlich der Anforderungen an die Etikettierung und Verpackung zur Gewährleistung der Produktqualität und der Patientensicherheit.
Nationale Vorschriften und Richtlinien
- Vorschriften vonHealth Canada : Sie regeln die Anforderungen an die Kennzeichnung von Arzneimitteln in Kanada und gewährleisten die Einhaltung von Sicherheits- und Wirksamkeitsstandards.
- Vorschriften der Japanischen Agentur für Arzneimittel und MedizinproduktePMDA): Legen die Anforderungen für die Kennzeichnung und Verpackung von Arzneimitteln in Japan fest und gewährleisten die Produktqualität und -sicherheit.
Die Einhaltung dieser Vorschriften und Normen ist für Pharmaunternehmen von entscheidender Bedeutung, um die Einhaltung der Vorschriften zu gewährleisten, die Sicherheit der Patienten zu fördern und den Marktzugang für ihre Produkte zu erleichtern. Die Einhaltung dieser Anforderungen trägt zur Risikominderung bei und gewährleistet die Qualität, Wirksamkeit und Sicherheit pharmazeutischer Produkte.
Welche Auswirkungen hat die Nichteinhaltung von Vorschriften im Bereich Artwork
Die Nichteinhaltung artwork behördlichen artwork hat erhebliche Auswirkungen für Pharmaunternehmen, die sich sowohl auf den Bereich der öffentlichen Gesundheit als auch auf den geschäftlichen Bereich erstrecken. Die Nichteinhaltung artwork behördlichen artwork vielfältige Risiken für Pharmaunternehmen, die sich auf rechtliche, finanzielle, reputationsbezogene und betriebliche Aspekte erstrecken. Die proaktive Einhaltung von Compliance-Protokollen, robuste Qualitätssicherungssysteme und eine kontinuierliche behördliche Überwachung sind unerlässlich, um diese Risiken zu mindern und die behördliche Integrität bei artwork von Arzneimitteln zu wahren.
Im Folgenden werden die Folgen der Nichteinhaltung eingehend analysiert:
Bedenken in Bezug auf die Patientensicherheit
- Abweichungen von den regulatorischen Standards in artwork zu Ungenauigkeiten oder Auslassungen in den pharmazeutischen Informationen führen, wodurch das Risiko von Medikationsfehlern oder Nebenwirkungen bei Patienten erhöht wird.
- Eine unzureichende Kennzeichnung oder Verpackung könnte zu Verwirrung hinsichtlich der Dosierungsrichtlinien, Kontraindikationen oder Lagerungsanweisungen führen und damit das Wohlbefinden der Patienten gefährden.
Ordnungsrechtliche Sanktionen und Geldstrafen
- Die Aufsichtsbehörden verhängen strenge Strafen für die Nichteinhaltung artwork für artwork , darunter Geldstrafen, Produktrückrufe und Durchsetzungsmaßnahmen.
- Die Nichteinhaltung gesetzlicher Vorgaben kann die Marktzulassung behindern und die Markteinführung von Produkten und Markteinführungsstrategien verzögern.
Schädigung des Rufs
- Die Nichteinhaltung von Vorschriften untergräbt den Ruf und die Vertrauenswürdigkeit pharmazeutischer Unternehmen und schwächt das Vertrauen der Angehörigen der Gesundheitsberufe, der Patienten und der Aufsichtsbehörden.
- Negative Publicity aufgrund von Verstößen gegen Rechtsvorschriften oder Produktrückrufe kann sich nachhaltig negativ auf die Markenwahrnehmung und die Marktposition auswirken.
Rechtliche Haftung und Rechtsstreitigkeiten
- Nicht konforme artwork Unternehmen rechtlichen Risiken aus, darunter mögliche Klagen und Rechtsstreitigkeiten seitens betroffener Parteien oder Aufsichtsbehörden.
- Die finanzielle Belastung durch Prozesskosten, Vergleiche und Schadensersatz kann zu erheblichen Rückschlägen führen und die betriebliche Kontinuität stören.
Unterbrechungen der Lieferkette
- Verstöße gegen Vorschriften in artwork zu Produktrückrufen oder Sanktionen führen, wodurch Lieferketten unterbrochen werden und Lagerbestandsverluste, Produktionsverzögerungen und logistische Komplikationen entstehen können.
- Solche Unterbrechungen beeinträchtigen die Umsatzströme, die Kundenbeziehungen und die allgemeine Widerstandsfähigkeit des Unternehmens.
Verlust des Marktzugangs
- Die Nichteinhaltung von Vorschriften kann zu Marktbeschränkungen, Produktrücknahmen oder zum Verlust der Marktposition in den betroffenen Ländern führen und damit die Umsatzaussichten und Marktanteile schmälern.
- Die Wiederherstellung des Vertrauens der Aufsichtsbehörden und die Wiederherstellung der Marktpräsenz nach Verstößen gegen die Vorschriften erfordern viel Zeit, Ressourcen und strategische Anstrengungen.
Verstärkte behördliche Kontrolle
- Die Nichteinhaltung von Vorschriften führt zu einer verstärkten Prüfung, zu intensiveren Audits, Inspektionen und zur Überwachung der Einhaltung von Vorschriften durch die Aufsichtsbehörden.
- Eine verstärkte behördliche Überwachung führt zu zusätzlichem Verwaltungsaufwand, Kosten für die Einhaltung der Vorschriften und die Bereitstellung von Ressourcen für Abhilfemaßnahmen.
Wettbewerbsnachteil
- Die Nichteinhaltung von Vorschriften führt zu einer Verschlechterung der Wettbewerbsfähigkeit, da konforme Unternehmen sich auf dem Markt durchsetzen, an Glaubwürdigkeit gewinnen und in der Gunst der Verbraucher steigen.
- Die Nichteinhaltung der regulatorischen Vorgaben kann potenzielle Partnerschaften, Investitionen oder Kunden abschrecken und die Expansionsaussichten von Unternehmen einschränken.
Was sind die Herausforderungen im Bereich Artwork sich Pharmaunternehmen stellen müssen?
Die Navigation durch die Feinheiten artwork pharmazeutischen artwork einem stark regulierten Umfeld stellt Unternehmen dieser Branche vor besondere Herausforderungen. Das Erreichen eines empfindlichen Gleichgewichts zwischen Kreativität, Präzision und Einhaltung gesetzlicher Standards erfordert eine sorgfältige Planung und proaktive Ansätze. Im Folgenden sind einige der wichtigsten Hürden aufgeführt, denen Pharmaunternehmen bei der Verwaltung artwork begegnen:
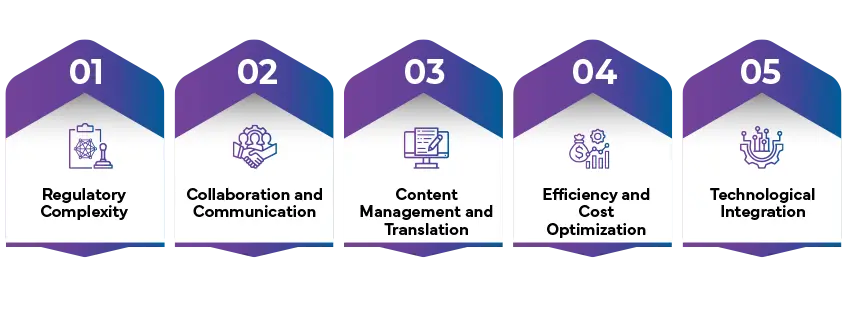
Komplexität der Rechtsvorschriften
- Ständige Weiterentwicklung der Vorschriften: Es ist eine große Herausforderung, mit den sich ständig ändernden Vorschriften in verschiedenen Regionen Schritt zu halten. Artwork bestimmten Kriterien hinsichtlich Inhalt, Format, Sprache und Symbolik entsprechen, die je nach Zielmarkt variieren.
- Auslegung von Richtlinien: Die genaue Entschlüsselung und Umsetzung von Richtlinien der Regulierungsbehörden erfordert spezielles Wissen und akribische Aufmerksamkeit für Details, um Fallstricke der Nichteinhaltung zu vermeiden.
Zusammenarbeit und Kommunikation
- Vielfältige Interessengruppen: An artwork sind verschiedene Interessengruppen beteiligt, darunter Designer, Marketingteams, Regulierungsexperten und externe Mitarbeiter. Eine effektive Koordination und Kommunikation zwischen diesen unterschiedlichen Einheiten ist unerlässlich, um einen reibungslosen Arbeitsablauf zu gewährleisten.
- Versionskontrolle und Überwachung: Die Verwaltung mehrerer Iterationen von artwork der Überprüfungs- und Freigabephasen stellt eine Herausforderung dar und erfordert robuste Mechanismen, um Änderungen zu verfolgen, Fehler zu vermeiden und Transparenz zu gewährleisten.
Content Management und Übersetzung
- Präzision und Vollständigkeit: Die Gewährleistung der Genauigkeit, Vollständigkeit und Konsistenz aller artwork , einschließlich Dosierungsanweisungen, Warnhinweisen und Kontraindikationen, ist für den Schutz des Wohlergehens der Patienten von entscheidender Bedeutung.
- Kulturelle Erwägungen: Die Übersetzung von Inhalten für globale Märkte erfordert Sensibilität für kulturelle und rechtliche Nuancen, um Fehlinterpretationen zu vermeiden und eine verständliche Kommunikation zu ermöglichen.
Effizienz und Kostenoptimierung
- Zeitintensive Verfahren: Die sorgfältige Prüfung und die Genehmigungsprotokolle, die durch die Vorschriften vorgeschrieben sind, können viel Zeit in Anspruch nehmen, was die Produkteinführung behindern und die Fristen für den Marktzugang beeinträchtigen kann.
- Ressourcenallokation: Die effektive Verwaltung artwork und Überprüfung artwork sowie die Einhaltung gesetzlicher Vorschriften erfordern spezielle Ressourcen und Fachkompetenzen, was für Unternehmen mit finanziellen Auswirkungen verbunden ist.
Technologische Integration
- Kompatibilität bestehender Systeme: Die Integration neuartiger Technologien in bestehende Altsysteme stellt eine Herausforderung dar und kann die Effizienz der Prozesse und die Interoperabilität der Daten beeinträchtigen.
- Datensicherheit und Einhaltung gesetzlicher Vorschriften: Die Implementierung robuster Datensicherheitsmaßnahmen ist unerlässlich, um sensible Patientendaten während des gesamten artwork zu schützen und strenge Datenschutzbestimmungen einzuhalten.
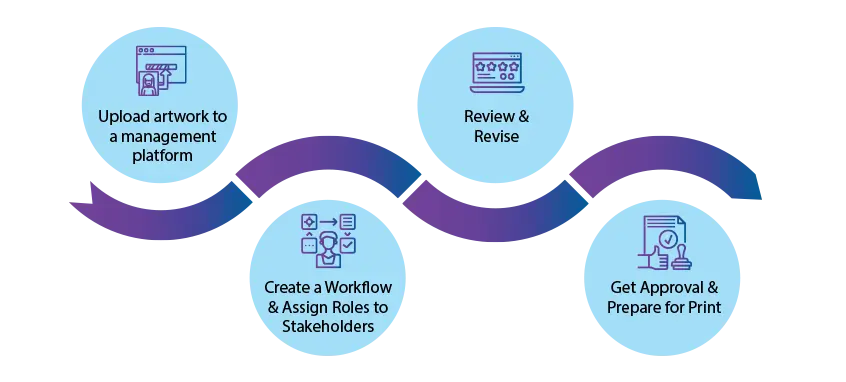
Wie geht Ihr Team mit Artwork um?
Der artwork ist ein umfangreicher Prozess, der zwischen einigen Tagen und mehreren Monaten dauern kann. Um nur eine einzige artwork und für die Produktion vorzubereiten, müssen möglicherweise Ihr Designteam, die Rechtsabteilung und alle anderen Beteiligten einbezogen werden.
Um die Probleme bei der Erfassung von Feedback von verschiedenen Teams, die oft über den ganzen Globus verstreut sind, zu vermeiden, wenden sich viele Unternehmen an Software zur Entwurfsgenehmigung.
Hier sind vier Schritte, die Ihnen dabei helfen werden, Ihren artwork zu optimieren.
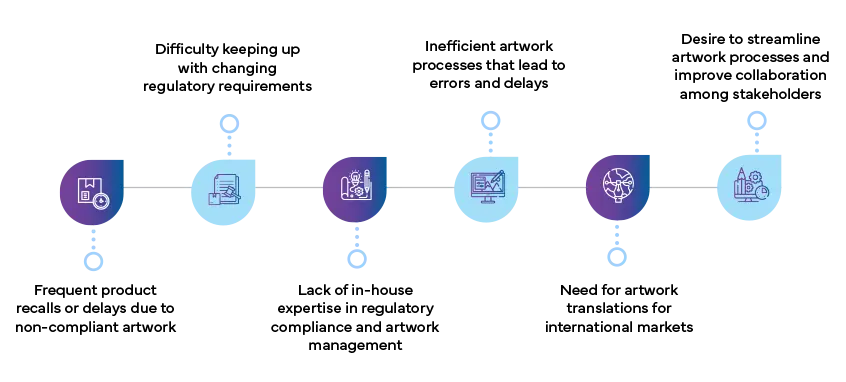
Was sind die Anzeichen dafür, dass Ihr Unternehmen einen Dienstleister Artwork benötigt?
Hier sind einige wichtige Anzeichen dafür, dass Ihr Unternehmen von einer Partnerschaft mit einem artwork profitieren könnte:
Was sind die Vorteile einer Partnerschaft mit einem Artwork ?
- Kompetenz in der Einhaltung gesetzlicher Vorschriften: Die Zusammenarbeit mit spezialisierten artwork gewährleistet die Einhaltung strenger gesetzlicher Vorschriften für Produktkennzeichnung, Verpackung und artwork, die für die Einhaltung gesetzlicher Vorschriften und den Schutz des Wohlbefindens der Patienten von entscheidender Bedeutung sind.
- Strenge Qualitätssicherung: Die Zusammenarbeit mit Anbietern artwork garantiert höchste Sorgfalt und Präzision, unterstützt durch strenge Qualitätskontrollmaßnahmen, die gründliches Korrekturlesen, Fehlererkennung und sorgfältiges Revisionsmanagement umfassen.
- Einsatz fortschrittlicher Technologien: Durch den Einsatz modernster Technologien und Automatisierungsfunktionen wie CAD-Software (Computer-Aided Design) und CMS (Content Management Systeme) werden die Prozesse artwork optimiert, wodurch die Effizienz gesteigert und die Durchlaufzeiten verkürzt werden.
- Anpassungsfähigkeit und Skalierbarkeit: Anbieter Artwork bieten anpassungsfähige und skalierbare Lösungen, die sich an unterschiedliche artwork hinsichtlich Umfang und Komplexität anpassen lassen und sowohl kleine als auch große Projekte nahtlos abdecken.
- Globale Compliance und Lokalisierung: Mit ihrer Expertise im Management artwork gewährleisten Anbieter die Einhaltung sprachlicher und kultureller Vorgaben in verschiedenen Märkten und sorgen so für Genauigkeit und Konsistenz in Botschaften und Inhalten.
Wie kann Freyr Sie weltweit unterstützen?
Freyr sich durch ein umfassendes Angebot an regulatorischen Dienstleistungen Freyr , das von einem Team von Experten unterstützt wird, die sich mit den Feinheiten der regulatorischen Rahmenbedingungen in verschiedenen Rechtsordnungen weltweit bestens auskennen. Mit fundierten Kenntnissen über Vorschriften wie die FDA den Vereinigten Staaten, EMA Europa und verschiedener Regulierungsbehörden in Ländern des asiatisch-pazifischen Raums Freyr maßgeschneiderte Compliance-Lösungen, die auf die spezifischen Anforderungen jedes Marktes zugeschnitten sind. Dazu gehören sorgfältige Lokalisierungsdienstleistungen, die sicherstellen, dass artwork an verschiedene Regionen und Sprachen angepasst werden, um die Zielgruppen weltweit effektiv anzusprechen.
Darüber hinaus erstreckt sich das Engagement Freyr für regulatorische Exzellenz auch auf die kontinuierliche Überwachung regulatorischer Änderungen und Aktualisierungen, sodass Kunden sich sicher in der sich wandelnden Compliance-Landschaft bewegen können. Mit einem globalen Netzwerk von Niederlassungen und Partnern Freyr nahtlosen Support für Kunden, die in verschiedenen Märkten tätig sind, und unterstützt sie bei der Entwicklung effizienter regulatorischer Strategien, lokalen Zulassungen und artwork . Darüber hinaus Freyr kulturelle Sensibilität beim artwork und berücksichtigt kulturelle Nuancen, um die Akzeptanz und das Engagement des lokalen Publikums zu erhöhen.
- Umfassende Kenntnisse der Rechtsvorschriften: Freyr verfügt über ein Team von Zulassungsexperten mit umfassenden Kenntnissen der lokalen Vorschriften in verschiedenen Regionen. Ob es sich um die FDA in den USA, die EMA in Europa oder die Aufsichtsbehörden im asiatisch-pazifischen Raum handelt, unsere Experten sind mit den Feinheiten der jeweiligen Rechtsprechung bestens vertraut.
- Maßgeschneiderte Compliance-Lösungen: Wir bieten maßgeschneiderte Compliance-Lösungen, die auf die spezifischen regulatorischen Anforderungen jedes Marktes zugeschnitten sind. Durch die Nutzung unserer lokalen Expertise stellen wir sicher, dass artwork , Etikettierung und Verpackung alle geltenden Vorschriften erfüllen, was einen reibungslosen Markteintritt und die Erteilung von Genehmigungen erleichtert.
- Lokalisierungsdienstleistungen: Freyr umfassende Lokalisierungsdienstleistungen, um artwork an verschiedene Regionen und Sprachen anzupassen. Von der Übersetzung von Texten bis hin zur Anpassung von Bildern und Symbolen an kulturelle Vorlieben sorgen wir dafür, dass artwork bei den Zielgruppen weltweit artwork .
- Aktuelles zu regulatorischen Entwicklungen: Unser Team beobachtet kontinuierlich regulatorische Änderungen und Aktualisierungen in verschiedenen Regionen. Indem wir den sich wandelnden Vorschriften immer einen Schritt voraus sind, helfen wir unseren Kunden, sich in einem sich wandelnden Compliance-Umfeld zurechtzufinden und ihre artwork proaktiv anzupassen, um die Compliance zu gewährleisten.
- Globales Netzwerk: Mit einem globalen Netzwerk aus Niederlassungen und Partnern Freyr nahtlosen Support für Kunden, die in verschiedenen Märkten tätig sind. Ob es um die Festlegung von Regulierungsstrategien, die Einholung lokaler Genehmigungen oder die Verwaltung artwork geht – unsere lokale Präsenz gewährleistet eine effiziente und effektive Einhaltung der Vorschriften weltweit.
- Kulturelle Sensibilität: Freyr ist sich der Bedeutung kultureller Sensibilität beim artwork bewusst und Freyr , dass die Materialien der Kunden beim lokalen Publikum Anklang finden. Von Farbvorlieben bis hin zur Auswahl der Bilder – wir berücksichtigen kulturelle Nuancen beim artwork , um die Akzeptanz und das Engagement zu steigern.
Warum Freyr?
Regulatorisches Fachwissen
Angesichts der strengen regulatorischen Standards für pharmazeutische artwork ist Fachwissen im Bereich Compliance von entscheidender Bedeutung, um die Einhaltung gesetzlicher Vorschriften und die Sicherheit der Patienten zu gewährleisten.
Strategische Partnerschaften
Der Aufbau enger Beziehungen zu den Kunden fördert die Zusammenarbeit und ermöglicht maßgeschneiderte Lösungen, die spezifische Bedürfnisse und langfristige Ziele effektiv erfüllen.
Prozesse der Qualitätskontrolle
Die Gewährleistung von Genauigkeit und Präzision bei artwork strenge Qualitätskontrollmaßnahmen schützt vor Fehlern und Verstößen gegen Vorschriften.
Beweglichkeit und Flexibilität
In einem dynamischen regulatorischen Umfeld ist die Fähigkeit, sich schnell an Veränderungen anzupassen, von entscheidender Bedeutung für die Einhaltung der Vorschriften und die Erfüllung der sich wandelnden Kundenbedürfnisse.
Umfassende Dienstleistungen
Das Angebot von end-to-end artwork optimiert den Prozess für Kunden und bietet Unterstützung in jeder Phase, von der Konzeptentwicklung bis zur endgültigen Freigabe.
Fortschrittliche Technologie-Integration
Der Einsatz von Technologie erhöht die Effizienz und Genauigkeit bei artwork , was zu kürzeren Durchlaufzeiten und einer verbesserten Qualität beiträgt.
Transparente Kommunikation
Eine offene und transparente Kommunikation fördert das Vertrauen und die Zusammenarbeit und gewährleistet, dass die Kunden während des gesamten Prozesses informiert und einbezogen werden.
Kontinuierliche Innovation
Innovation treibt den Fortschritt voran und sorgt dafür, dass artwork auf dem neuesten Stand bleiben und in einer sich ständig weiterentwickelnden Branche optimale Ergebnisse für Kunden liefern.
Flexibilität und Skalierbarkeit
Die Fähigkeit, sich auf wechselnde Anforderungen einzustellen und den Betrieb nach Bedarf zu skalieren, gewährleistet, dass die Kunden einen anpassungsfähigen und reaktionsschnellen Service erhalten.
Umfassende Schulung und Unterstützung
Durch die Vermittlung von Wissen und Fähigkeiten werden die Kunden in die Lage versetzt, die rechtlichen Anforderungen selbständig zu bewältigen, was ihre Eigenständigkeit und ihren langfristigen Erfolg fördert.
Fokus auf Nachhaltigkeit
Umweltverantwortung steht im Einklang mit den allgemeinen Unternehmenswerten und trägt zu einer nachhaltigeren Zukunft bei, indem sie das Engagement für soziale und ethische Standards demonstriert.
Häufig gestellte Fragen
Regulatorische artwork umfassen die Erstellung, Verwaltung und Einreichung von pharmazeutischen Verpackungen und Etiketten, die den globalen regulatorischen Standards entsprechen. Diese Dienstleistungen umfassen artwork , Einhaltung von Etikettierungsvorschriften, Lokalisierung, Übersetzung, regulatorische Informationen, Verwaltung artwork und Qualitätssicherung.
GMP-Grundsätze verbessern artwork sie für Klarheit, Genauigkeit, Risikomanagement, Rückverfolgbarkeit und Compliance sorgen. Diese Praktiken reduzieren Fehler, verbessern die Effizienz und erhalten den Ruf der Marke, während gleichzeitig die Patientensicherheit gewährleistet wird.
Die Nichteinhaltung der Vorschriften kann zu Problemen bei der Patientensicherheit, Sanktionen durch die Behörden, Rufschädigung, rechtlicher Haftung, Unterbrechung der Lieferkette, Verlust des Marktzugangs, verstärkter Kontrolle durch die Behörden und Wettbewerbsnachteilen führen. Um diese Risiken zu vermeiden, müssen Unternehmen die Vorschriften einhalten.
Die Automatisierung der artwork rationalisiert den Prozess, reduziert Fehler, gewährleistet Konsistenz und spart Zeit und Kosten. Automatisierte Systeme können Unstimmigkeiten schnell erkennen und die Einhaltung von Vorschriften sicherstellen, wodurch die Gesamtqualität und Effizienz des Druckvorlagenprüfungsprozesses verbessert wird.
Die Blockchain-Technologie ist ein dezentrales, verteiltes Ledgersystem, das Transaktionen auf vielen Computern so aufzeichnet, dass die registrierten Transaktionen nicht nachträglich geändert werden können. Im Zusammenhang mit regulatorischen artwork kann die Blockchain die Datensicherheit und Rückverfolgbarkeit über den gesamten artwork hinweg verbessern und so das Vertrauen und die Transparenz innerhalb des regulatorischen Rahmens fördern.
ISO-Normen sind international anerkannte Richtlinien und Anforderungen, die die Qualität, Sicherheit und Effizienz von Produkten, Dienstleistungen und Systemen gewährleisten. In der pharmazeutischen Industrie spielen ISO-Normen wie ISO 11607 für die Verpackung von Medizinprodukten und ISO 13485 für Qualitätsmanagementsysteme eine entscheidende Rolle bei der Einhaltung von Vorschriften und der Gewährleistung, dass Verpackung und Kennzeichnung die gesetzlichen und sicherheitstechnischen Anforderungen erfüllen.
Unter Verpackungsdesign versteht man den Prozess der Gestaltung der visuellen und strukturellen Elemente von Produktverpackungen, einschließlich der Gestaltung von Etiketten, Schachteln, Flaschen und anderen Verpackungsformaten. In der pharmazeutischen Industrie muss das Verpackungsdesign die gesetzlichen Anforderungen erfüllen und gleichzeitig sicherstellen, dass alle notwendigen Informationen an die Endverbraucher weitergegeben werden, einschließlich Dosierungsanweisungen, Warnhinweise und andere wichtige Produktdetails.
Produktinformationsmanagement (PIM) ist ein System oder Prozess, mit dem alle Daten zu einem Produkt verwaltet und zentralisiert werden, um sicherzustellen, dass auf verschiedenen Plattformen und Medien genaue und konsistente Informationen verwendet werden. Im Bereich artwork regulatorischen artwork trägt PIM zur Optimierung des artwork bei, indem es sicherstellt, dass die aktuellsten und genauesten Produktinformationen verwendet werden, wodurch Fehler reduziert und die Einhaltung regulatorischer Standards verbessert werden.











