BIMO steht für „Bioresearch Monitoring“ (Biologische Forschungsüberwachung) und ist ein Programm zur Vor-Ort-Inspektion und Datenprüfung, mit dem alle Aspekte der Durchführung und Berichterstattung von Forschungsarbeiten überwacht werden, die der US and Drug Administration (FDA) unterliegen. Das Programm wurde 1977 ins Leben gerufen, nachdem ein Bedarf an der Prüfung klinischer Forschungsstandorte festgestellt worden war. Das Hauptziel dieses Programms ist es, die Qualität und Integrität der eingereichten Daten für die Zulassung neuer Produkte und die Vermarktung sicherzustellen. Darüber hinaus schützt dieses Programm auch die Rechte und das Wohlergehen von Menschen und Tieren, die an der FDA Forschung beteiligt sind.
Die wichtigsten Ziele des BIMO-Programms
Jährlich werden über 1000 Inspektionen durchgeführt. Die wichtigsten Ziele des BIMO-Programms sind:
- Audit klinischer Daten
- Einsichtnahme in die laufende klinische Forschung
- Inspektion von nicht-klinischen Laboratorien
- Inspektion der Institutionellen Prüfungsausschüsse (IRB)
Welche Produkte fallen in den Geltungsbereich von BIMO Audit?
Die BIMO gilt für Arzneimittel, Biologika, Medizinprodukte, Lebensmittel, Tabakwaren und Veterinärprodukte. Das Compliance-Programm wird von den sechs (06) Produktzentren der FDAbeaufsichtigt - dem Center for Biologics Evaluation and Research (CBER), dem Center for Devices and Radiological Health (CDRH), dem Center for Drug Evaluation and Research (CDER), dem Center for Food Safety and Applied Nutrition (CFSAN), dem Center for Tobacco Products (CTP) und dem Center for Veterinary Medicine (CVM).
Welche Unternehmen werden einem BIMO-Audit unterzogen?
Sowohl inländische als auch internationale Unternehmen, die eine der unten angeführten Tätigkeiten ausüben oder darunter fallen, unterliegen den Anforderungen des Bioresearch Monitoring -
- Nichtklinische Prüflaboratorien zur Einhaltung der Guten LaborpraxisGLP)
- Klinische Prüfer für die Einhaltung der guten klinischen Praxis (GCP)
- Förderer
- Auftragsforschungsinstitute (CROs)
- Monitore für klinische Prüfungen
- In-vivo-Bioäquivalenzeinrichtungen
- Institutionelle Prüfungsausschüsse (IRBs)
Welche Compliance-Programme fallen unter das BIMO-Programm?
Die US FDA jederzeit ein BIMO-Audit im Rahmen der sieben (07) Multi-Center-Compliance-Programme durchführen. Diese sieben Multi-Center-Compliance-Programme werden umgesetzt durch –
- Inspektion des klinischen Prüfers (CI) und des Sponsor Investigators (SI)
- Überprüfung durch das Institutionelle Prüfungsamt (IRB)
- Inspektion von Auftragsforschungsinstituten/Sponsoren/MonitorenCRO)
- Inspektion der Guten LaborpraxisGLP)
- Prüfung der Bioäquivalenz und Bioverfügbarkeit (BEQ)
- Inspektion der Berichte über unerwünschte Arzneimittelwirkungen nach der Markteinführung (PADE)
- Inspektion der Risikobewertung, Risikominderung und Strategie (REMS) Berichterstattung
Jedes dieser Programme beschreibt einen detaillierten Umfang der Überprüfung oder Inspektion, die durchgeführt werden muss, um die Einhaltung der FDA zu gewährleisten.
Welche Vorschriften gelten für das BIMO-Audit?
Für das BIMO-Audit gelten die Vorschriften 21 CFR 50 - Protection of Human Subjects, 21 CFR 54-Financial Disclosure, 21 CFR 56-IRBs, 21 CFR 58-Good Laboratory Practice for non-clinical laboratories, 21 CFR 809-In Vitro Diagnostic Products, und 21 CFR 812-Investigational Device Exemption.
Wie viele Audits werden jährlich im Rahmen des BIMO-Programms durchgeführt?
Die Anzahl der von der US FDA durchgeführten BIMO-AuditsFDA von Jahr zu Jahr. In den letzten Jahren ist die Anzahl der Vor-Ort-Inspektionen aufgrund des Ausbruchs der COVID-19-Pandemie zurückgegangen, und die FDA alle Vor-Ort-Überwachungen der klinischen Studien aussetzen. Nur bestimmte kritische und entscheidende klinische Studien wurden überwacht.
Die "Remote Regulatory Assessments" (RRAs) wurden während der COVID-19-Pandemie eingeführt, um die regulierte Forschung aus der Ferne zu überwachen. RRAs werden über Videokonferenzen durchgeführt und sind eine freiwillige Initiative zur Fernbewertung der Daten und Prozesse. Dabei ist jedoch zu beachten, dass RRAs nicht gleichwertig oder eine Alternative zur Inspektion vor Ort sind, sondern lediglich ein Verfahren, das sich aufgrund der COVID-19-Pandemie entwickelt hat.
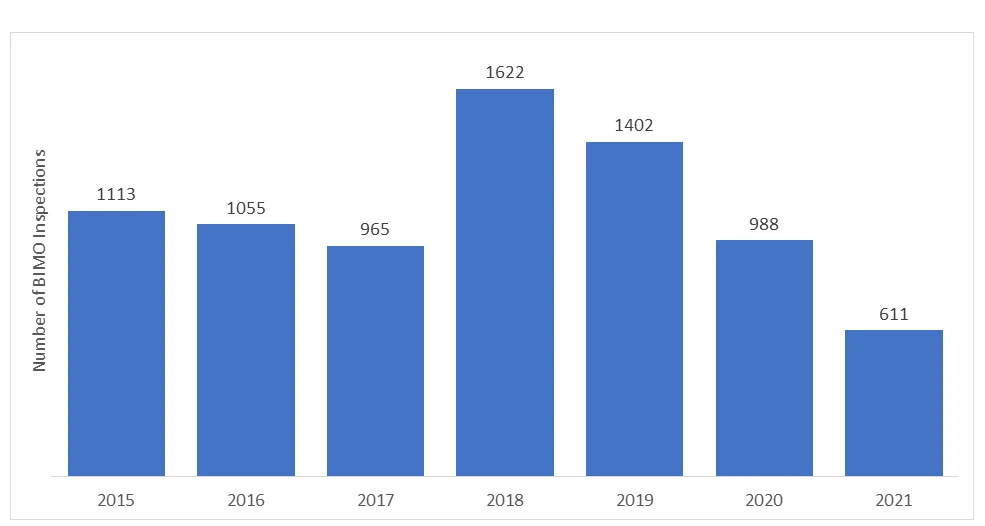
*Die für die Jahre 2020 und 2021 dargestellten Daten enthalten keine RRA-Inspektionen
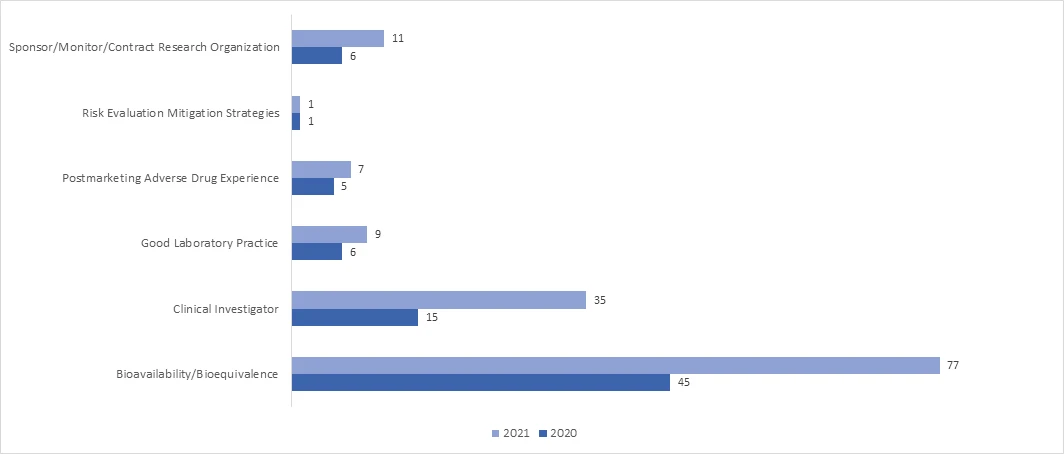
Wie viele Fernprüfungen von Rechtsvorschriften (Remote Regulatory Assessments, RRAs) wurden während der COVID-19-Pandemie im Rahmen des BIMO-Programms durchgeführt?
Im Jahr 2021 wird die Einführung von RRA-Inspektionen in allen Programmen deutlich zunehmen. Im April 2021 veröffentlichte die FDA einen Leitfaden mit dem Titel "Remote Interactive Evaluations of Drug Manufacturing and Bioresearch Monitoring Facilities During the COVID-19 Public Health Emergency Guidance for Industry" (Interaktive Fernüberprüfungen von Einrichtungen zur Herstellung von Arzneimitteln und zur Überwachung der Bioforschung während des COVID-19-Notfalls für die öffentliche Gesundheit - Leitfaden für die Industrie), der ausführliche Informationen über das Verfahren der FDAzur Durchführung von RRAs enthält.
Was sind die möglichen Ergebnisse eines BIMO-Audits?
Während des BIMO-AuditsFDA die US FDA je nach Einhaltung der Vorschriften eine der folgenden Maßnahmen ergreifen:
1. Keine Maßnahme angezeigt (NAI)
NAI ist anwendbar, wenn der FDA vor Ort keine beanstandeten Praktiken oder nur geringfügige Probleme festgestellt hat, bei denen weitere Maßnahmen nicht gerechtfertigt sind.
2. Freiwillige Maßnahme angezeigt (VAI)
VAI ist anwendbar, wenn beanstandete Praktiken zwar festgestellt wurden, aber nicht erheblich sind.
3. Angezeigte amtliche Maßnahme (OAI)
Die OAI ist anwendbar, wenn unzulässige Praktiken festgestellt werden, die die Integrität der Daten und/oder die Rechte der betroffenen Personen gefährden.
Was sind die häufigsten Nichtkonformitäten, die im Rahmen des BIMO-Audits festgestellt werden?
Einige der häufigsten Nichtkonformitäten, die während des BIMO-Audits festgestellt wurden, sind -
- Nicht ordnungsgemäßes Führen von Aufzeichnungen
- Nichteinhaltung des Versuchsplans
- Nichteinhaltung der Vorschriften
- Versäumnisse bei der Überwachung der Protokolle
- Unzureichender Schutz von Personen
- Unzureichende Verantwortlichkeit für das untersuchte Produkt
Das BIMO-Audit ist für jeden Entwickler oder Hersteller neuartiger medizinischer Geräte und Technologien, der plant, sein Produkt auf dem US einzuführen, von entscheidender Bedeutung. Die Einhaltung der Vorschriften und Richtlinien zur Vermeidung der beschriebenen Fallstricke ist äußerst wichtig.
Benötigen Sie Unterstützung bei BIMO-Audit-Prüfungen? Reach an Freyr. Bleiben Sie informiert. Bleiben Sie compliant.