Ninsho (Zertifizierung von Medizinprodukten) ist ein unabhängiges Zertifizierungssystem in Japan, bei dem eine vom Minister für Gesundheit, Arbeit und Soziales (MHLW) akkreditierte Registrierte Zertifizierungsstelle (RCB) bestimmte streng kontrollierte Medizinprodukte zertifiziert. Es gilt für Produkte der Klasse II und eine begrenzte Anzahl von Produkten der Klasse III, für die es eine entsprechende japanische Industrienorm (JIS) gibt. Einige wenige Medizinprodukte der Klasse II, für die keine festgelegten Zertifizierungskriterien existieren, müssen im Rahmen des Shonin-Programms zugelassen werden.
Welche anderen Wege der Produktregistrierung gibt es in Japan?
In Japan werden für die Zulassung von Medizinprodukten neben dem Ninsho-Verfahren auch die Verfahren Todokede und Shonin verwendet. Abhängig von der Risikokategorie des Produkts und der Verfügbarkeit von Prädikaten in Japan muss der Hersteller die Einreichung seines Produkts sorgfältig planen.
Was sind die Voraussetzungen für die Ninsho-Zertifizierung?
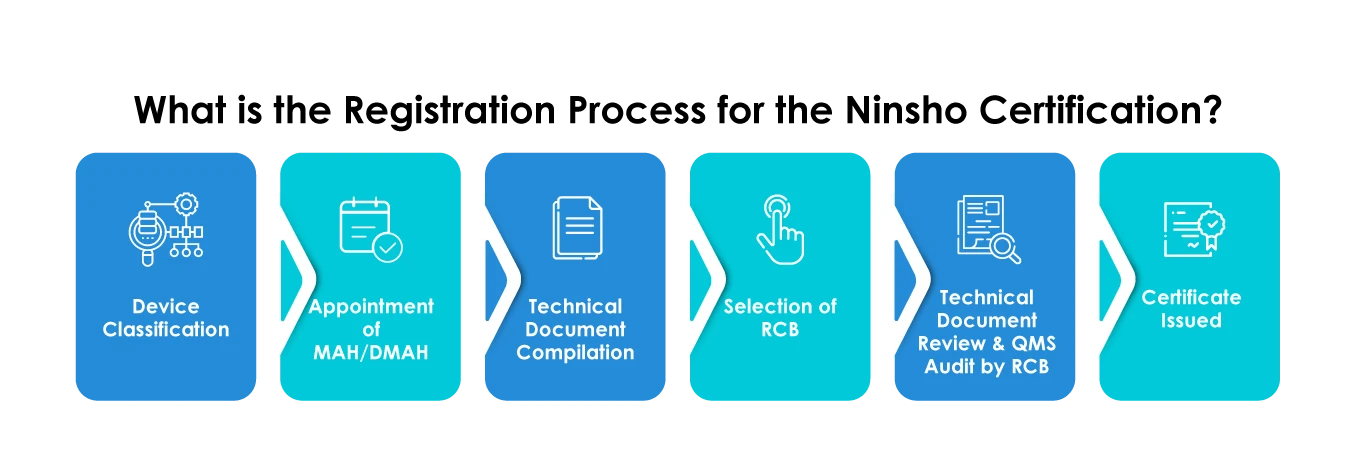
Hersteller, die ihre Produkte über den Ninsho-Pfad registrieren lassen, müssen die Einreichungen im Hinblick auf die folgenden Punkte sorgfältig planen:
- Auswahl eines RCB
- Einreichung allgemeiner Produktdaten wie Kategorie des Medizinprodukts, Verwendungszweck, Daten zur Wirksamkeitsrisikoanalyse, klinische Daten usw.
- Bereitstellung einer Zusammenfassung der technischen Dokumentation (STED)
- Die Dokumente sollten nur in japanischer Sprache zur Verfügung gestellt werden.
- Ausländische Hersteller müssen zwingend einen Zulassungsinhaber (MAH) oder einen designierten Zulassungsinhaber (DMAH) benennen.
- Ausländische Hersteller müssen sich beim MHLW registrieren lassen MHLW für ihre Produktionsstätten ein Zertifikat zur Registrierung ausländischer Hersteller (FMR) einholen.
Was sind RCBs?
Die registrierten Zertifizierungsstellen (RCBs) sind vom MHLW akkreditierte unabhängige Zertifizierungsstellen. Die RCBs sind für die Prüfung und Zertifizierung von Medizinprodukten zuständig, die für das Ninsho-Verfahren in Frage kommen und im Rahmen dieses Verfahrens beantragt werden. Die RCBs sind auch für die Durchführung des QMS-Audits in den Einrichtungen des Herstellers verantwortlich.
Was sind die QMS-Anforderungen für die Produktregistrierung im Rahmen des Ninsho-Pfads?
Die Hersteller müssen alle in der Verordnung 169 festgelegten QMS-Anforderungen erfüllen. Der MAH oder DMAH muss den Antrag bei den RCBs einreichen. Die RCBs führen eine ausführliche QMS-Inspektion in der Anlage des Herstellers durch und stellen bei zufriedenstellender Umsetzung des QMS das Zertifikat aus.
Wie lange dauert es im Durchschnitt, bis die Ninsho-Zertifizierung erreicht ist?
Das RCB benötigt in der Regel drei (03) bis fünf (05) Monate, um die technische Bewertung abzuschließen, das QMS-Audit durchzuführen und das Ninsho-Zertifikat auszustellen.
Gibt es einen Zeitplan für den Ablauf der Ninsho-Zertifizierung?
Die Registrierung von Medizinprodukten läuft nicht ab, aber der Sponsor sollte die QMS-Zertifikate alle fünf (05) Jahre erneuern.
Japan ist nach den USA und China der drittgrößte Markt für Medizinprodukte und bietet Medizinprodukteherstellern weltweit große Chancen. Hersteller, die ihre Produkte in Japan vermarkten möchten, müssen die Zertifizierung und Zulassung von Medizinprodukten sorgfältig planen, da PMDA spezifische regulatorische Anforderungen PMDA . Hersteller können sich für einen zuverlässigen Partner im Bereich Regulatory Affairs entscheiden, um einen reibungslosen Zugang zum japanischen Markt zu erhalten.
Um mehr über die Zertifizierung von Medizinprodukten in Japan oder andere Vorschriften PMDA zu erfahren, wenden Sie sich noch heute an Freyr!