Innovative Medizinprodukte sind unerlässlich, um die Ergebnisse der Gesundheitsversorgung zu verbessern, den sich wandelnden medizinischen Bedürfnissen gerecht zu werden und kosteneffiziente Lösungen für Patienten und Gesundheitsdienstleister anzubieten. Die SAKIGAKE-Strategie ist ein beschleunigtes Prüfungs- und Zulassungsverfahren für innovative Medizinprodukte in Japan. Diese Strategie wurde 2015 vom japanischen Ministerium für Gesundheit, Arbeit und SozialesMHLW) mit dem Ziel initiiert, die Entwicklung und Vermarktung innovativer Medizinprodukte in Japan zu beschleunigen.
Im Rahmen der SAKIGAKE-Strategie können Medizinprodukte, die bestimmte Innovationskriterien erfüllen, von der Pharmaceuticals and Medical Devices AgencyPMDA), der für die Zulassung von Medizinprodukten in Japan zuständigen Behörde, vorrangig geprüft und zugelassen werden. Zu den Kriterien für die Ausweisung von Innovationen gehören die folgenden:
- Produkte mit herausragender Wirksamkeit; es wird erwartet, dass das Produkt mit einem neuartigen Wirkmechanismus einen signifikanten klinischen Nutzen und eine radikale Verbesserung für die Patienten im Vergleich zu bestehenden Medizinprodukten bietet.
- Erstens kann das Gerät in Japan oder gleichzeitig in Japan und anderen Ländern zugelassen werden.
- Das Produkt hat das Potenzial, einen ungedeckten medizinischen Bedarf in Japan zu decken. Die Zielkrankheit sollte schwer, lebensbedrohlich oder mit anhaltenden Symptomen verbunden sein.
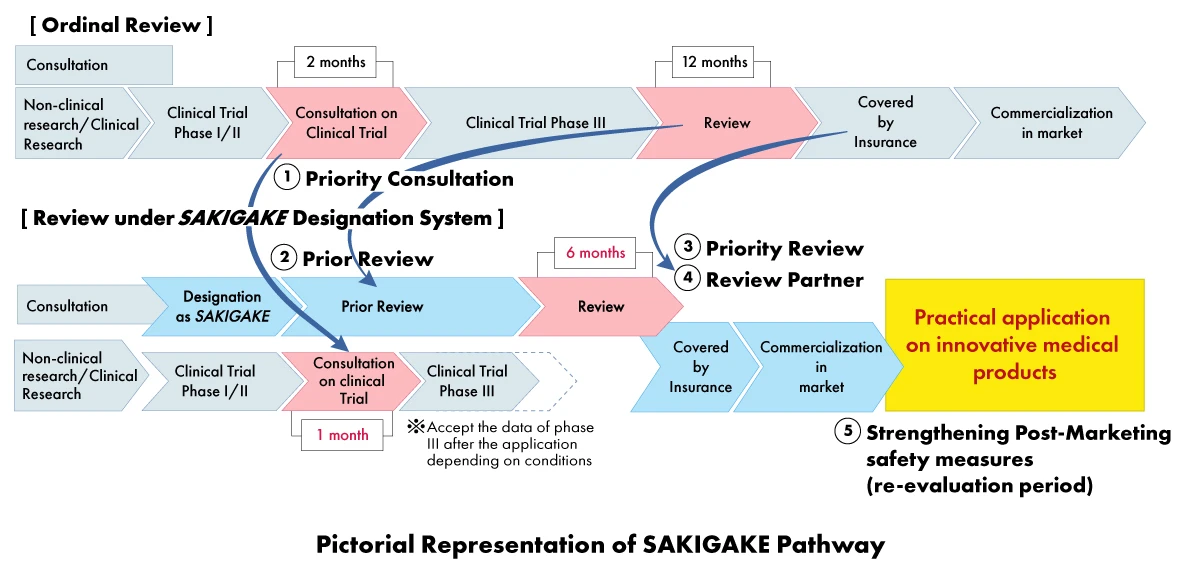
Im Rahmen der SAKIGAKE-Strategie können Hersteller von Medizinprodukten eine Reihe von Vorteilen erhalten, darunter:
- Vorrangige Konsultation: Verkürzung der Wartezeit für die Beratung zu klinischen Studien auf einen (01) Monat.
- Vorrangige Überprüfung: SAKIGAKE-ausgewiesene Produkte werden vorrangig geprüft, mit dem Ziel, das Prüfverfahren innerhalb von sechs (06) Monaten statt 12 Monaten abzuschließen.
- Effektive Überprüfung vor der Bewerbung: Ermutigung zur Konsultation und Annahme von Materialien in englischer Sprache.
- Dedizierter Prüfpartner: Jedem von SAKIGAKE benannten Produkt wird ein eigener Prüfmanager für den gesamten Genehmigungsprozess zugewiesen.
- Verstärkung der Sicherheitsmaßnahmen nach dem Inverkehrbringen: Verlängerung des Überprüfungszeitraums und Erleichterung der Zusammenarbeit mit wissenschaftlichen Gesellschaften.
Wie kann man sich bewerben?
- Durch den Antragsteller: Der Antragsteller reicht den Antrag bei der PMDA Evaluation and Licensing Division (ELD) ein.
- Von PMDA: ELD wendet sich an einen potenziellen Bewerber.
P.C- PMDA, Japan.
Insgesamt bietet das SAKIGAKE-System einen beschleunigten Weg für die Entwicklung und Zulassung innovativer Medizinprodukte in Japan. Es zielt darauf ab, die Ergebnisse für die Patienten zu verbessern und die Innovation in der Medizinprodukteindustrie zu fördern. Der Hersteller muss die PMDA frühzeitig im Entwicklungsprozess konsultieren, um die regulatorischen Anforderungen zu erörtern und Feedback zu seinen Produktentwicklungsplänen zu erhalten.
Wenn Sie mehr über die Zulassungswege für Medizinprodukte in Japan erfahren möchten, reach Sie sich jetzt an einen Zulassungsexperten! Bleiben Sie informiert. Bleiben Sie compliant.