Shonin (Pre-Market Approval) ist das Zulassungsverfahren für Medizinprodukte in Japan. Das Shonin-Verfahren dient in erster Linie der Zulassung von Medizinprodukten der Klassen II und III, für die keine Klassifizierungsstandards PMDAvorliegen. Auch für risikoreiche Produkte der Klasse IV müssen Hersteller einen Shonin-Antrag stellen. PMDA für die Prüfung und Genehmigung des Shonin-Antrags zuständig.
Welche anderen Wege der Produktregistrierung gibt es in Japan?
Neben dem Shonin-Verfahren werden in Japan auch die Todokede- und Ninsho-Verfahren für die Zulassung von Medizinprodukten verwendet. Die Hersteller von Medizinprodukten können sich je nach Risikoklasse des Produkts und der Verfügbarkeit von Prädikaten in Japan für einen der beiden Wege entscheiden. Der Hersteller muss die Produktklassifizierung ermitteln und die Verfügbarkeit der japanischen Industrienorm (JIS) recherchieren, bevor er den anwendbaren Zulassungspfad bestimmt.
- Todokede (Vor der Markteinführung einzureichender Antrag) – Gilt für Produkte der Klasse I und verpflichtet Hersteller, vor der Markteinführung einen Antrag bei der PMDA Genehmigung einzureichen.
- Ninsho (Zertifizierung vor dem Inverkehrbringen) - Sie gilt für generische Produkte der Klassen II und III mit Zertifizierungsstandards (JIS-Standards). Die registrierte Zertifizierungsstelle (RCB) ist für die Prüfung und Genehmigung des Antrags zuständig.
Was sind die Voraussetzungen für die Shonin-Registrierung?
Hersteller, die ihre Produkte über den Shonin-Weg registrieren lassen, müssen die Einreichungen sorgfältig planen. Sie müssen Folgendes sicherstellen:
- Einreichung allgemeiner Produktdaten, wie z. B. Kategorie des Medizinprodukts, Verwendungszweck, Daten zur Risikoanalyse der Wirksamkeit, klinische Daten usw.
- Bereitstellung einer Zusammenfassung der technischen Dokumentation (STED)
- Bereitstellung von Dokumenten nur in japanischer Sprache
- Die ausländischen Hersteller müssen zwingend einen Zulassungsinhaber (MAH) oder einen designierten Zulassungsinhaber (DMAH) benennen
- Ausländische Hersteller müssen für ihre Produktionsstätten eine Bescheinigung über die Registrierung als ausländischer Hersteller (FMR) erhalten.
Was sind die QMS-Anforderungen für die Produktregistrierung im Rahmen des Shonin-Pfads?
Die Hersteller müssen alle in der Verordnung 169 festgelegten QMS-Anforderungen erfüllen. Der Sponsor oder DMAH oder MAH muss einen Antrag bei der PMDA stellen. Die PMDA eine detaillierte QMS-Inspektion der Anlage des Herstellers durch und stellt nach zufriedenstellender Umsetzung des QMS das Zertifikat aus.
Wie sieht das Registrierungsverfahren für die Produktzulassung im Rahmen des Shonin-Pfads aus?
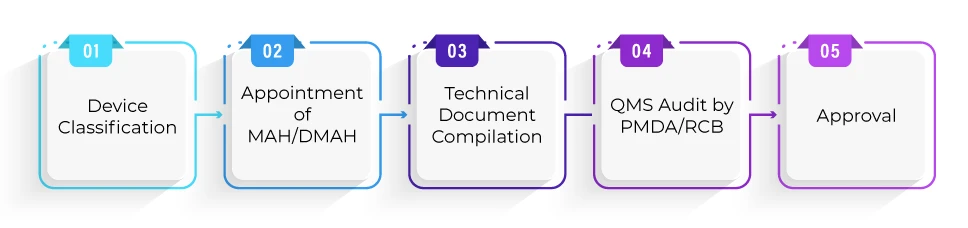
Wie lange dauert es im Durchschnitt, bis ein Produkt im Rahmen des Shonin-Verfahrens zugelassen wird?
Die PMDA benötigt PMDA 12 Monate für die technische Bewertung ab dem Datum des Eingangs des Shonin-Antrags. Der Hersteller muss die für die Vorbereitung der Einreichungsunterlagen oder die Durchführung klinischer Studien erforderliche Zeit in seinem Projektzeitplan berücksichtigen.
Gibt es eine Ablauffrist für die Produktregistrierung nach dem Shonin-Pfad?
Die Registrierung von Medizinprodukten läuft nicht ab, aber der Sponsor sollte die QMS-Zertifikate alle fünf (05) Jahre erneuern.
Japan ist ein lukrativer Markt, der jedoch mit komplexen Vorschriften und sprachlichen Barrieren verbunden ist. Die Hersteller müssen diese Faktoren berücksichtigen und ihre Markteinführungsstrategie (GTM) für Japan proaktiv planen. Die Hersteller von Medizinprodukten und IVD können sich dafür entscheiden, alle regulatorischen Feinheiten an einen zuverlässigen Partner auszulagern und ihre Ressourcen auf andere wichtige Komponenten zu konzentrieren.
Wenn Sie mehr über die Zulassung von Medizinprodukten nach Shonin in Japan oder andere Vorschriften PMDA erfahren möchten, wenden Sie sich noch heute an die Regulierungsexperten Freyr.