Das Hauptanliegen US FDAist es, die Regulierungsprozesse für den ununterbrochenen Import und Verkauf neuer und hochwertiger Medizinprodukte auf dem US ständig zu überprüfen und Lücken zu schließen. Die US FDA veröffentlichteFDA ein Programm mit dem Titel „The New 510(k) Paradigm: Alternate Approaches to Demonstrating Substantial Equivalence in Premarket Notifications” (Das neue 510(k)-Paradigma: Alternative Ansätze zum Nachweis der wesentlichen Gleichwertigkeit in Vorab-Meldungen). Damit soll ein effizienter FDA (k)-Einreichungsweg geschaffen werden, der bestimmte Änderungen gegenüber dem bereits genehmigten 510(k)-Antrag enthält. Diese neue 510(k)-Meldung bietet drei Arten von Einreichungen, nämlich Special 510(k), Abbreviated 510(k) und Traditional 510(k). Die US FDA hat 2019 einen speziellen 510(k)-Leitfaden herausgegeben, in dem ein optionaler Weg für Hersteller beschrieben wird, die bestimmte genau definierte Änderungen an ihren legal vermarkteten Produkten vornehmen.
Warum eine spezielle 510(k)?
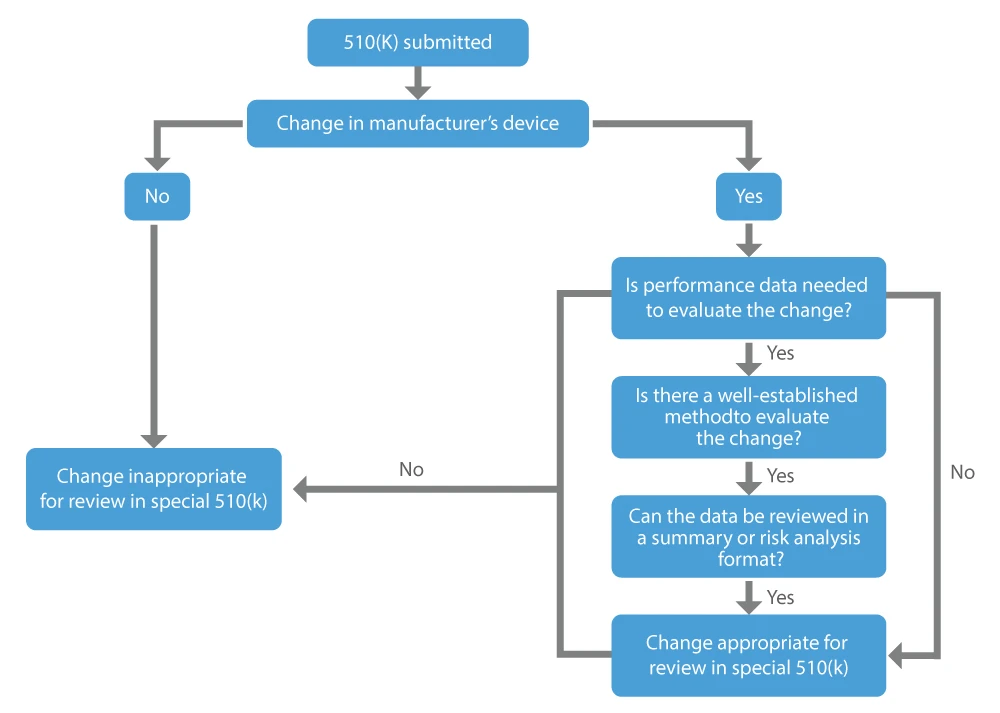
Wenn ein Hersteller eine Genehmigung für die Änderungen wünscht, die er an einem bereits auf dem Markt befindlichen Produkt vorgenommen hat, kann er eine spezielle 510(k) beantragen. Die wichtigsten Faktoren, die bei der Entscheidung, ob eine Änderung an einem bestehenden Produkt für eine spezielle 510(k) geeignet ist, zu berücksichtigen sind, sind die folgenden:
- Die Änderung betrifft das eigene, rechtmäßig in Verkehr gebrachte Prädikatsprodukt des Antragstellers.
- Leistungsdaten sind nicht erforderlich, oder es stehen bewährte Methoden zur Verfügung, falls dies zur Bewertung der Änderung für notwendig erachtet wird.
- Alle Leistungsdaten, die zur Feststellung der wesentlichen Gleichwertigkeit erforderlich sind, können in Form einer Zusammenfassung oder einer Risikoanalyse überprüft werden.
Erforderliche Dokumente für spezielle 510(k)
- Anschreiben
- Die Bezeichnung des rechtmäßig in Verkehr gebrachten (vorhandenen) Produkts des Herstellers und die 510(k)-Nummer
- Ausführliche Beschreibung der am Produkt vorgenommenen Änderung(en), die zur Einreichung einer neuen 510(k) geführt hat (haben)
- Ein Vergleich des geänderten Geräts mit dem freigegebenen Gerät in tabellarischer Form
- Andere Änderungen der Kennzeichnung oder des Designs
- Eine knappe Zusammenfassung der Entwurfskontrolltätigkeiten
- Auf der Grundlage der Risikoanalyse eine Identifizierung der Verifizierungs- und/oder Validierungsaktivitäten, die zur Einhaltung von 21 CFR 820.30 erforderlich sind
- Formular für Anwendungshinweise
- Eine Erklärung, dass der Antragsteller die Anforderungen an das Konstruktionskontrollverfahren gemäß 21 CFR 820.30 erfüllt hat und derzeit nicht dagegen verstößt, und dass die Aufzeichnungen auf Anfrage zur Überprüfung zur Verfügung stehen
Sonderzeitplan für die 510(k)-Prüfung durch die US FDA
Gemäß den FDA"Refuse to Accept Policy for 510(k)s" beträgt die Überprüfungsfrist für spezielle 510(k)-Einreichungen dreißig (30) Tage nach deren Eingang.
Wann ist ein spezieller 510(k)-Antrag zu stellen?
Die US FDA kontinuierlich darum, sichere und wirksame Medizinprodukte zur Förderung der menschlichen Gesundheit bereitzustellen. Das Sonderprogramm 510(k) ist effizient und entspricht dem am wenigsten aufwendigen Prüfverfahren, das ausländischen Herstellern den Verkauf ihrer Produkte in den USA erleichtert und Patienten einen zeitnahen Zugang zu neuen Medizinprodukten ermöglicht.
Wenn Sie weitere Informationen über das spezielle 510(k)-Verfahren der FDAbenötigen, reach Sie sich an Freyr - einen ausgewiesenen Experten für Regulierungsfragen. Bleiben Sie informiert. Bleiben Sie compliant.