
A Administração de Alimentos e Medicamentos dos Estados Unidos (US FDA) divulgou orientações em dezembro de 2022, uma revisão das orientações intituladas «Falha em responder a uma Carta de Resposta ANDA (CRL) ANDA dentro do prazo regulamentar para a indústria», de julho de 2022. O objetivo é orientar os requerentes de Pedidos Abreviados de Novos Medicamentos (ANDAs) apresentados nos termos da secção 505(j) da Lei Federal sobre Alimentos, Medicamentos e Cosméticos (FD&C Act) (21 U.S.C. 355(j)). Uma resposta completa e relevante a uma CRL é crucial para a aprovação do medicamento genérico. O documento de orientação oferece recomendações sobre as repercussões do recebimento de uma CRL e as medidas FDA tomar se a CRL não for respondida dentro do prazo especificado.
A FDA garantir que os medicamentos genéricos aprovados cumpram as normas de segurança, qualidade, eficácia e acessibilidade. Se o ANDA cumprir os requisitos FDA , é enviada uma CRL ao requerente, incluindo as deficiências identificadas durante a sua avaliação.
Segue-se uma descrição figurativa do que um candidato pode fazer no prazo de um ano após a receção do LCR:
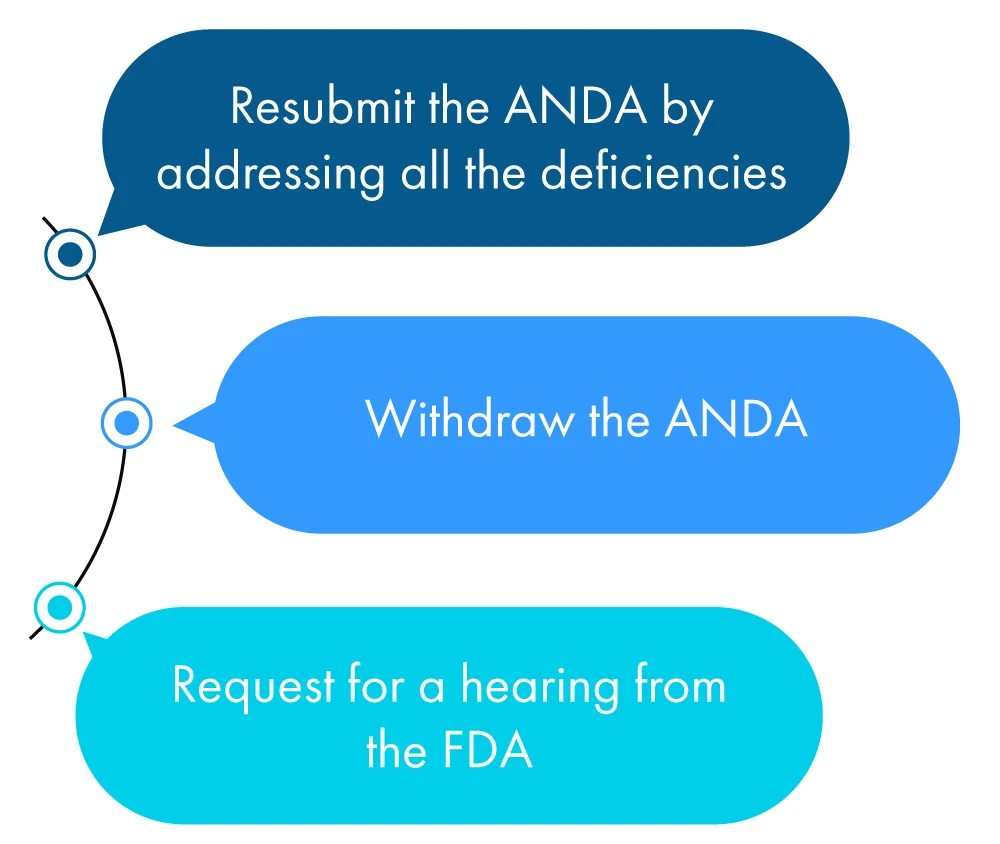
Se nenhuma das ações acima for tomada pelo requerente, a FDA isso como um pedido de retirada da ANDA o requerente tenha solicitado uma prorrogação do prazo para verificar todas as discrepâncias mencionadas na CRL.
O que acontece após um (01) ano da emissão da LCR?
A FDA uma notificação por escrito informando que o requerente tem trinta (30) dias a partir da notificação para o seguinte:
- Apresente as razões pelas quais o ANDA não ANDA ser retirado.
- Pedido de prorrogação do prazo para resolver todas as deficiências mencionadas no LCR
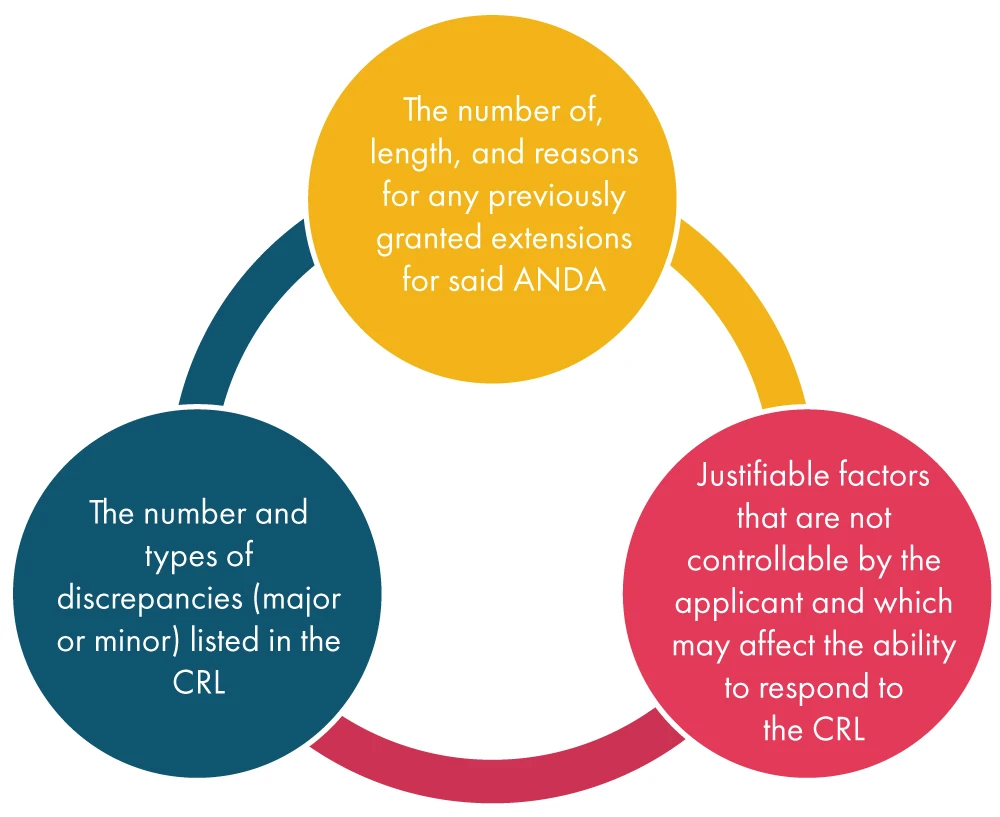
Assim que a FDA um pedido de prorrogação do requerente, ela considera vários fatores, conforme mencionado abaixo, e, posteriormente, decide sobre o pedido:
O que é uma alteração?
O requerente precisa apresentar um pedido de prorrogação para responder a uma CRL por meio de uma alteração. A FDA uma alteração como maior ou menor com base no efeito que ela tem sobre o processo de aprovação.
FDA vitais FDA que os requerentes devem conhecer:
- A FDA uma alteração menor como uma alteração significativa se a alteração for apresentada após um ano da CRL, a menos que a ANDA para um produto incluído na lista de escassez de medicamentos nos termos da secção 506E da Lei FD&C (21 U.S.C. 356e), ou for objeto de uma resposta a uma Emergência de Saúde Pública, conforme declarado pelo Secretário do US de Saúde e Serviços Humanos US , nos termos da secção 319 da Lei dos Serviços de Saúde Pública (42 U.S.C. 247d), ou se previr que estará sujeita aos mesmos critérios aplicáveis a tal declaração, no momento da apresentação.
- Se o requerente não resolver as discrepâncias na CRL dentro do prazo prorrogado concedido pela FDA, esta última poderá considerar a retirada da ANDA.
- Se o requerente precisar de mais do que o período de prorrogação de trinta (30) dias, poderá solicitar uma nova prorrogação. A alteração deverá incluir novas informações que permitam à FDA se a prorrogação pode ser concedida ou não.
Obter uma CRL da FDA ser bastante assustador para ANDA . Desde resolver as discrepâncias até citar as razões/informações corretas para uma prorrogação, todos os requisitos relevantes devem ser cumpridos para garantir uma aprovação mais rápida do medicamento. A Freyr é uma especialista regulatória comprovada, com amplo conhecimento em responder a CRLs e garantir a conformidade com FDA . Entre em contacto connosco agora para obter suporte end-to-end em ANDA .









