Os radiofármacos são medicamentos que contêm radioisótopos, utilizados como agentes diagnósticos e terapêuticos. Eles têm como alvo órgãos, tecidos ou células específicos do corpo humano. Esses Medicamentos ser administrados por via oral, intravenosa ou intersticial e constituem uma subespecialidade da radioterapia. Existem regulamentações rigorosas para a comercialização de radiofármacos, uma vez que eles só podem ser administrados por um profissional especializado em medicina nuclear. No entanto, as oportunidades são imensas devido à sua capacidade de diagnosticar certos problemas médicos ou tratar doenças como o cancro. O mercado global de radiofármacos atingiu aproximadamente US9 mil milhões em 2022 e espera-se que reach US,93 mil milhões em 2030, crescendo a uma taxa composta de crescimento anual (CAGR) de 11,76%.
Empresas farmacêuticas de todo o mundo estão a tentar conquistar a sua quota do mercado de radiofármacos, incluindo as do Canadá. Health Canada HC), a Health Authority (HA) canadiana Health Authority (HA) é conhecida pelos seus esforços em disponibilizar serviços de saúde de alta qualidade ao público. Existem diretrizes/regulamentos rigorosos para garantir a segurança dos pacientes em primeiro lugar. Os fabricantes/patrocinadores que desejam entrar no mercado canadense de radiofármacos devem compreender os regulamentos estabelecidos pela HC e, consequentemente, elaborar a estratégia ideal de submissão para obter uma aprovação mais rápida no mercado.
O roteiro regulamentar para a apresentação de produtos radiofarmacêuticos no Canadá
Todos os medicamentos comercializados no Canadá devem seguir a Lei de Alimentos e Medicamentos (FDA) e os Regulamentos de Alimentos e Medicamentos (FDR). Os radiofármacos estão listados no Anexo C da FDA. A Direção de Terapias Biológicas e Genéticas (BGTD), HC, regula a autorização de comercialização desses produtos. Eles são aprovados para uso humano com base na avaliação satisfatória da segurança, eficácia e qualidade dos radiofármacos apresentados.
A HC é membro oficial do Conselho Internacional para a Harmonização dos Requisitos Técnicos para Medicamentos de Uso Humano (ICH). Adotou os ICH relacionados com qualidade, segurança, eficácia e temas multidisciplinares. A lista desses documentos está disponível no site da HC para referência dos patrocinadores.
Além dos documentos acima mencionados, o Guia para a Indústria: Gestão de Submissões de Medicamentos (documento de orientação), atualizado pela última vez em 2 de agosto de 2022, us a perspetiva da HC na avaliação das informações submetidas pelos patrocinadores sobre radiofármacos. O quadro abaixo (Figura 1) apresenta uma visão geral dos tópicos abordados no documento de orientação.
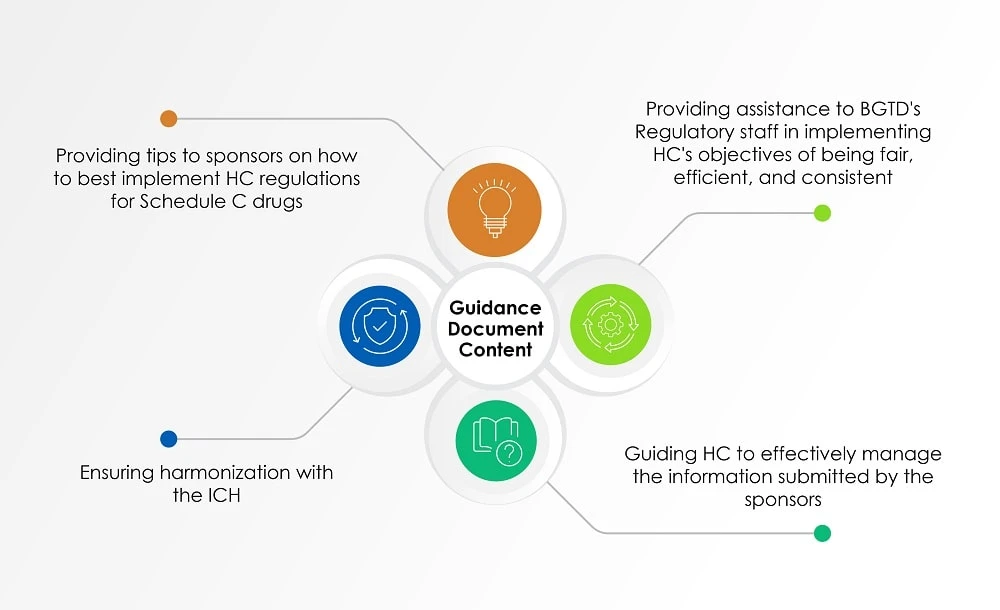
Figura 1: Conteúdo de um documento de orientação
Os requisitos regulamentares para medicamentos da Tabela C são os mesmos que para outros medicamentos. Os requisitos incluem a apresentação de documentos e o cumprimento do processo para obtenção Autorização de Introdução no Mercado. No entanto, os requisitos relativos aos dados a apresentar são diferentes dos outros medicamentos devido às suas propriedades específicas.
NDS
O fabricante/patrocinador do medicamento deve apresentar ao BGTD uma submissão de novo medicamento (NDS), que deve conter os seguintes dados:
- Informações sobre a segurança, a qualidade e a eficácia do medicamento.
- Relatórios/resultados de ensaios pré-clínicos e clínicos.
- Informações sobre o fabrico do medicamento.
- Indicações relativas à rotulagem e à embalagem.
- Alegações terapêuticas e potenciais efeitos secundários do medicamento.
O promotor pode fazer uma apresentação perante o BGTD antes de apresentar a NDS. Esta reunião prévia à apresentação é benéfica, uma vez que o promotor pode abordar eventuais lacunas/questões levantadas pelo BGTD e garantir que a apresentação contém todas as informações necessárias. Idealmente, a reunião deve ter lugar três (03) meses antes da data-limite de apresentação das propostas.
Os promotores também podem considerar vias de revisão alternativas, como uma Revisão Prioritária ou um Aviso de Conformidade com Condições (NOC/c). Segue-se um resumo de cada uma das duas vias:
- Revisão prioritária: Esta via aplica-se a uma NDS ou a um Suplemento a uma Apresentação de um Novo Medicamento (SNDS) para uma doença/condição que ponha em risco a vida ou seja gravemente incapacitante e para a qual existam provas suficientes da eficácia do medicamento em termos de diagnóstico, tratamento ou prevenção da referida condição. É igualmente aplicável quando existe um aumento substancial da eficácia e/ou uma diminuição considerável do risco para uma doença que não dispõe de um medicamento eficaz no mercado canadiano.
- NOC/c: Esta via considera a avaliação dos riscos e benefícios de um medicamento. A NOC/c é para um medicamento que tem um perfil de segurança aceitável para uma doença/condição que ameaça a vida ou é gravemente incapacitante. A autorização é concedida com provas favoráveis para o medicamento radiofarmacêutico. Esta via aplica-se à NDS, SNDS e à Apresentação Abreviada de um Novo Medicamento (ANDS).
O formato NDS
O HC adoptou o formato de Documento Técnico Comum Eletrónico (eCTD) para a apresentação de medicamentos radiofarmacêuticos. De facto, foram criados modelos separados de resumo de informações sobre a qualidade, como o QIS-R e o QIS-PER, para as apresentações de medicamentos radiofarmacêuticos.
Conclusão
Enquanto o HC regulamenta a autorização de comercialização de medicamentos radiofarmacêuticos com base na avaliação satisfatória da segurança, eficácia e qualidade dos produtos apresentados, a Comissão Canadiana de Segurança Nuclear (CNSC) regulamenta a segurança radiológica dos medicamentos radiofarmacêuticos. A CNSC controla aspectos como o manuseamento, a embalagem, a rotulagem, o armazenamento, a eliminação, etc., de materiais radioactivos. Também estabelece regulamentos para o equipamento utilizado no fabrico de medicamentos radiofarmacêuticos.
A conformidade com os regulamentos atuais da HC e da CNSC é essencial para a avaliação satisfatória dos pedidos de registro de medicamentos radiofarmacêuticos. Faça parceria com um especialista regulatório comprovado como Freyr atividades de publicação e envio sem erros e sem complicações no Canadá. Mantenha-se informado! Mantenha-se em conformidade!









