
A maioria das organizações da área de ciências da vida tem dificuldade em otimizar o seu processo de submissão de regulamentações devido às frequentes alterações nas diretrizes de submissão. De acordo com uma análise recente realizada pela Food and Drug Administration (USFDA) dos Estados Unidos, 32% das submissões com dados de estudos apresentavam problemas críticos de conformidade de dados. O processo exige um amplo entendimento da colaboração entre as partes interessadas internas e externas. Dentro da organização, os departamentos de produção, investigação e desenvolvimento, investigação clínica/não clínica, QA, marketing e vendas devem trabalhar em harmonia para acelerar o processo de aprovação, desde o desenvolvimento inicial até ao momento em que o medicamento chega ao mercado. O Assuntos Regulamentares e as Autoridades Sanitárias (HAs) estão em constante comunicação para garantir e avaliar a segurança e eficácia dos medicamentos para uso humano. Vejamos quais as medidas preliminares que as organizações farmacêuticas devem tomar para estabelecer a excelência nas submissões regulatórias:
Atribuir e utilizar recursos para simplificar, normalizar e acelerar o trabalho de apresentação desorganizado
Um especialista em submissões participa numa base contratual e pode compreender mais de um (01) tipo de submissão, estando associado a programas de desenvolvimento ao longo dos anos, auxiliando na elaboração de narrativas convincentes para o dossiê. Isso facilita às organizações:
- Eliminar erros equilibrando a colaboração das partes interessadas internas e externas
- Reduzir o ciclo de revisão de HA do processo de criação e aprovação de documentos
- Elaborar apresentações completas e conformes para acompanhar a evolução dos requisitos regulamentares dos diferentes mercados
- Reconhecer as submissões afectadas por uma autoridade reguladora
- Estar ciente do estado da criação, revisão e aprovação de submissões
- Melhoria do atual protocolo de apresentação
Simplificar a metodologia de apresentação de dossiês
A elaboração de um dossiê é fundamental na preparação de submissões. Observa-se que os Pedidos de Licença Biológica (BLAs) e os Pedidos de Novo Medicamento (NDAs) compreendem milhares de páginas, dificultando a compreensão da narrativa do dossiê pelos reguladores. Ter uma representação estruturada de uma ideia geral pode ampliar a capacidade da equipa de preparar submissões e das agências de analisá-las.
A utilização de módulos para simplificar os envios permite aos especialistas analisar o que deve ser incluído em cada secção ou módulo do dossiê. Tal prática facilita:
- Início precoce da criação, acelerando a preparação da apresentação da organização
- Utilização dos dados relevantes necessários para a redação das apresentações
- Utilização de recursos adequados sem necessidade de redigir documentos extensos de raiz para cada apresentação
Trabalhar em colaboração com as autoridades reguladoras
Todas as organizações devem realizar reuniões regulares com as AS como prática durante a fase inicial do desenvolvimento do produto. Isto assegura uma análise e um feedback atempados, resultando numa resolução rápida dos comentários por parte da AS e, consequentemente, no processo de aprovação. Não só cria uma boa relação entre as organizações e a AS, como também ajuda a obter clareza numa fase inicial do planeamento da apresentação.
Simplificar o conteúdo e os dados no Sistema de Gestão Documental (DMS)
Espera-se que um repositório de conteúdo robusto lide com todos os dados em todas as áreas funcionais, incluindo a documentação e as informações criadas anteriormente. O conteúdo estruturado e o repositório de dados fornecem acesso contínuo a documentos de várias áreas funcionais, sem qualquer esforço extra ou necessidade de duplicação. Os documentos armazenados no DMS tornam-se a única fonte de contacto para todas as partes interessadas internas (ciência clínica, CMC, não clínica, farmacocinética, farmacodinâmica, redação médica e operações clínicas). Esse conteúdo e dados podem ser utilizados para criar conteúdo local com base nos requisitos regionais. Otimização de submissões regulatórias por meio de conteúdo estruturado e gestão de dados
Adotar a tecnologia e a automatização para reduzir o trabalho repetitivo e os erros
As organizações podem utilizar a tecnologia através da sua atualização automática e do controlo de qualidade das Tabelas, Listagens e Figuras (TLF) no texto em relação à funcionalidade de dados de origem para acelerar o processo de documentação. Desta forma, sempre que são feitas alterações às tabelas de origem existentes, é feita uma atualização no TLF no texto em conformidade. Isto ajuda a eliminar o número total de horas de trabalho, a poupar tempo no caminho crítico e a aumentar a exatidão dos dados.
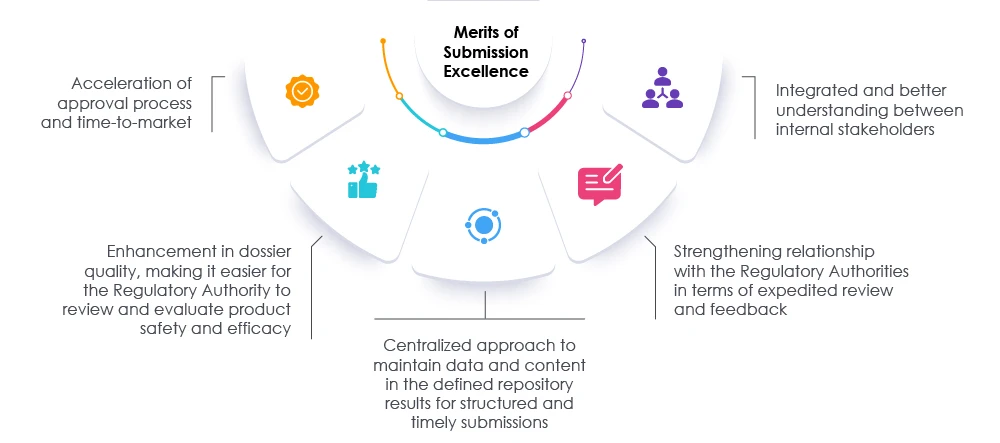
A adoção de medidas adequadas, juntamente com revisões oportunas dos dossiês e dos dados, pode ajudar tanto os reguladores quanto as organizações a acelerar o processo de submissão. Essa abordagem acelera o tempo de comercialização, de modo a atender às necessidades dos pacientes e da indústria. Um parceiro regulatório comprovado pode ajudar as organizações a repensar, reavaliar e modificar as abordagens atuais para a preparação de submissões. Os nossos especialistas na Freyr facilitar o caminho para alcançar a excelência nas submissões regulatórias, aumentando a visibilidade em toda a organização e promovendo a conformidade geral, permitindo que a organização tenha sucesso no mercado atual das ciências da vida. Consulte Freyr.









