Leistungsbewertung für Medizinprodukte - Überblick
Der Markt für Software as a Medical Device (SaMD) boomt weltweit aufgrund von Faktoren wie der steigenden Nachfrage nach Ferngesundheitsdiensten und der bevorstehenden Innovation im Bereich der digitalen Gesundheit. In Europa wird der SaMD im Zeitraum von 2021 bis 2027 voraussichtlich um etwa 27,1 % wachsen.
SaMD umfasst ein In-vitro-Diagnostikum (IVD). Es ist wichtig zu betonen, dass die EU-Verordnungen nicht den BegriffSoftware as a Medical Device SaMD)" verwenden. Stattdessen verwenden sie den Begriff "Medical Device Software", abgekürzt als MDSW.
In der Europäischen Union (EU) wird MDSW durch die Medizinprodukteverordnung (MDR) 2017/745 und die In-Vitro-Diagnostika-Verordnung (IVDR) 2017/746 geregelt. Diese Verordnungen bieten einen Rahmen für die Gewährleistung der Sicherheit und Leistung von Medizinprodukten, einschließlich MDSW, auf dem EU-Markt.
Wie kann Software als Medizinprodukt eingestuft werden?
Um festzustellen, ob Ihr Gerät von der EU als SaMD eingestuft wird, müssen Sie beurteilen, ob die Software für einen (01) oder mehrere medizinische Zwecke bestimmt ist, ohne Teil eines Hardware-Medizinprodukts zu sein. Wenn Ihre Software für sich genommen einen medizinischen Zweck erfüllt, könnte sie als SaMD eingestuft werden.
Wenn sie jedoch dazu bestimmt ist, ein medizinisches Hardware-Gerät anzusteuern oder ein integraler Bestandteil eines solchen Geräts ist, würde sie nicht als eigenständige Software und somit nicht als SaMD gelten. Stellen Sie stets sicher, dass Ihr Produkt den neuesten EU-Vorschriften und Richtlinien für Medizinprodukte entspricht.
Wie registriert man seine SaMD in der EU?
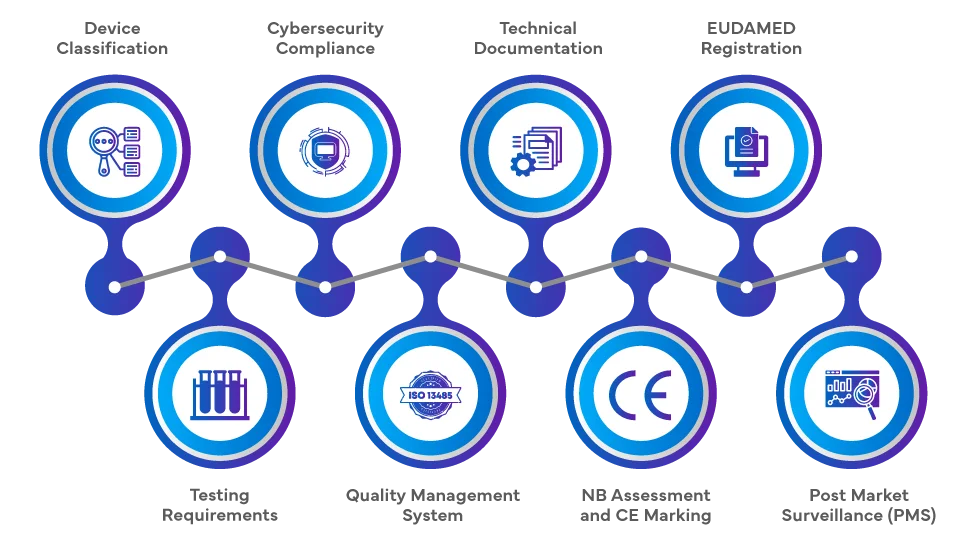
Der regulatorische Weg für die Einführung SaMD dem EU-Markt gemäß der EU MDR und der EU-IVDR 2017/746 umfasst eine Reihe umfassender Schritte. Hersteller müssen das Softwareprodukt anhand seines Verwendungszwecks und seines Risikograds klassifizieren, gefolgt von einer Konformitätsbewertung, an der bei höheren Risikoklassen möglicherweise eine benannte Stelle (NB) beteiligt ist. Technische Dokumentation, klinische Bewertung und die Einhaltung von Qualitätsmanagementsystemen (QMS) sind von entscheidender Bedeutung. Nach erfolgreicher Bewertung wird die CE-Kennzeichnung angebracht, und eine Registrierung in der Europäischen Datenbank für Medizinprodukte (EUDAMED) ist erforderlich. Post-market Surveillance (PMS) kontinuierliche Post-market Surveillance (PMS), Wachsamkeit und die Einhaltung von Cybersicherheitsanforderungen vervollständigen den regulatorischen Weg.
Häufig gestellte Fragen (FAQs)
Eine EU MDR ist ein Dokument, das von einer benannten BS als Ergebnis einer Konformitätsbewertung gemäß der Medizinprodukteverordnung der Europäischen UnionEU MDR 2017/745) oder der Verordnung über In-vitro-Diagnostika (IVDR) 2017/746 ausgestellt wird. Diese Bescheinigung bestätigt, dass ein Medizinprodukt die in der EU MDR festgelegten Anforderungen erfüllt, die Sicherheits-, Leistungs- und Qualitätsstandards umfassen. Das Zertifikat ist erforderlich, damit Medizinprodukte / In-vitro-Diagnostika in der EU legal in Verkehr gebracht werden können.
In der EU werden Medizinprodukte in vier (04) Risikoklassen eingeteilt: Klasse I, Klasse IIa, Klasse IIb und Klasse III. Die Klasse I steht für Produkte mit dem geringsten Risiko, und die Klasse III umfasst Produkte mit dem höchsten Risiko. Bei der Klassifizierung werden Faktoren wie die Invasivität des Produkts, die Dauer der Anwendung, der betroffene Körperteil und die potenziellen Risiken im Zusammenhang mit der technischen Auslegung und Herstellung des Produkts berücksichtigt.
Ebenso wird SaMD nach dem Risiko für Patienten und Anwender eingestuft, das von geringem Risiko (Klasse I) bis zu hohem Risiko (Klasse III) reicht.
Der BegriffSoftware as a Medical Device SaMD)" wird verwendet, wenn die Software für einen (01) oder mehrere medizinische Zwecke konzipiert ist und diese Funktionen unabhängig ausführt, ohne integraler Bestandteil eines medizinischen Hardware-Geräts zu sein. Andererseits wird der Begriff "Software in einem Medizinprodukt (SiMD)" verwendet, wenn die Software in ein medizinisches Gerät integriert ist, bekannt als eingebettete Software oder Firmware.
Es ist wichtig zu betonen, dass die EU-Verordnungen nicht den BegriffSoftware as a Medical Device" verwenden. Stattdessen verwenden sie den Begriff "Medical Device Software", abgekürzt MDSW.
"Medical Device Software (MDSW)" bezieht sich auf Software, die entweder allein oder in Kombination für einen Zweck bestimmt ist, der in der Definition eines "Medizinprodukts" gemäß der EU MDR 2017/745 und EU IVDR 2017/746 aufgeführt ist.
Die Zeit, die für die Zulassung eines SaMD in der EU benötigt wird, kann in Abhängigkeit von mehreren Faktoren erheblich variieren. Zu den wichtigsten Faktoren gehören die Klassifizierung des Produkts, seine Komplexität, der Weg der Konformitätsbewertung, die Einschaltung einer BS und die Effizienz des Zulassungsverfahrens.
SaMD in den anderen Märkten (EU/Australien/Korea) für Medizinprodukte
- Umfassende EU MDR für SaMDs.
- Unterstützung bei der Regulierung und Marktbeobachtung.
- Produktklassifizierungs- und Registrierungsdienste für SaMDs.
- Regulatorische Unterstützung für SaMD Produktentwicklungsdokumente.
- Beratungsdienste zu klinischen Evaluierungsstudien SaMD .
- Änderungsmanagement nach der Zulassung.
- EAR/UKRP/CH-Rep-Dienste.

- Erfolgreiche Einreichungen für verschiedene Klassen von SaMDs.
- Engagiertes und fachkundiges Personal für die Unterstützung bei der Regulierung.
- Pünktliche Einreichung der Arbeitsergebnisse.
- Zugang zu lokalen Tochtergesellschaften, um die Herausforderungen der Health Authority (HA) und sprachspezifische Anforderungen zu erfüllen.
- Unterstützung vor Ort oder durch einen Rechtsvertreter (LR), mit einem kosteneffizienten Modell.
- Dienstleistungen im Bereich der Verwaltung von Regelungsressourcen/Personalaufstockung.