Globale Regulatory Labeling Services die Pharmaindustrie
Nutzen Sie die jahrzehntelange Erfahrung unserer Regulatory Labeling services, die neue Produktzulassungen, Einreichungen bei Gesundheitsbehörden, Nachzulassungen, CMC und Lifecycle Management abdecken. Unser Schwerpunkt auf globaler und lokaler Exzellenz gewährleistet die strategische Erstellung und Aktualisierung wichtiger Kennzeichnungsdokumente wie IBs, CDS und CCDS und garantiert die Einhaltung von Vorschriften und den Erfolg in der Pharmaindustrie.
Themen durchsuchen
- Was ist eine gesetzliche Kennzeichnung?
- Warum ist die behördliche Kennzeichnung in der Pharmaindustrie so wichtig?
- Wie sieht das Genehmigungsverfahren für die Kennzeichnung aus?
- Was sind häufige Herausforderungen bei der gesetzlichen Kennzeichnung?
- Was sind die wichtigsten Vorschriften für die Kennzeichnung von Arzneimitteln?
- Wie kann ein Regulierungspartner dabei helfen, die Kennzeichnungsvorschriften einzuhalten?
- Wie können Unternehmen mit Regulatory Labeling Services beginnen?
- Können Regulatory Labeling Services bei der Überwachung nach dem Inverkehrbringen hilfreich sein?
- Warum Freyr wählen?
- Unsere Dienstleistungen
Was ist eine gesetzliche Kennzeichnung?
Zuletzt aktualisiert am: August, 2024
Die Kennzeichnung von Arzneimitteln umfasst die Erstellung, Prüfung und Verwaltung wichtiger Dokumente, die den Beteiligten wesentliche Produktinformationen vermitteln und die Einhaltung globaler Zulassungsstandards gewährleisten. Zu den wichtigsten Komponenten gehören das Core Data SheetCDS) und das Company Core Data SheetCCDS), die aus Quellen wie Broschüren zu Prüfverfahren und Daten nach der Markteinführung stammen. Dieser Prozess ist von zentraler Bedeutung für die Übermittlung von Sicherheits- und Wirksamkeitsinformationen auf länderspezifischen Etiketten und die Anpassung an die Anforderungen Health Authority (HA) .
Mit dem Schwerpunkt auf globaler Harmonisierung wird die Kennzeichnung von Arzneimitteln den sich entwickelnden regulatorischen Anforderungen gerecht, die neue Produktzulassungen, HA-Einreichungen, Nachzulassungen und Lifecycle-Management umfassen. Präzision und die Einhaltung der sich entwickelnden Richtlinien sind entscheidend für eine erfolgreiche pharmazeutische Kennzeichnung und beeinflussen die Marktzulassung eines Produkts, sein Sicherheitsprofil und seine allgemeine regulatorische Lebensfähigkeit.

Freyr, ein führender Anbieter von Regulatory labeling services end-to-end , verfügt über ein engagiertes Team von über 180 globalen Kennzeichnungsexperten, die sich durch die Erstellung wichtiger Dokumente wie Investigational Brochures (IB), Developmental Core Data Sheets und Developmental Core Safety Information auszeichnen. Der Einsatz künstlicher Intelligenz erhöht die Genauigkeit und beschleunigt die Umsetzung und Überprüfung von Datenblättern. Mit einer optimierten CCDS und präzisionsorientierten Prozessen erfüllen die umfassenden Dienstleistungen von Freyr effektiv die dynamischen Anforderungen der pharmazeutischen Industrie und bieten beispiellose Unterstützung für die Einhaltung von Kennzeichnungsvorschriften und den Erfolg bei der Zulassung.
Warum ist die behördliche Kennzeichnung in der Pharmaindustrie so wichtig?
- Gewährleistung der Patientensicherheit und Informationsvermittlung: Die vorschriftsmäßige Kennzeichnung ist für die Patientensicherheit von entscheidender Bedeutung. Die Etiketten enthalten wichtige Informationen über die Verwendung von Medikamenten, Dosierungen, Nebenwirkungen und Kontraindikationen. Patienten, verschreibende Ärzte, medizinisches Fachpersonal und Pflegepersonal verlassen sich auf diese Angaben, um fundierte Entscheidungen zu treffen. Eine klare und genaue Kennzeichnung verringert das Risiko von Medikationsfehlern, Nebenwirkungen und Missbrauch.
Sie stellt sicher, dass die Patienten die richtige Behandlung erhalten und deren korrekte Anwendung verstehen. Darüber hinaus verlangen die Regulierungsbehörden, dass jedes auf dem Markt befindliche pharmazeutische Produkt eine Kennzeichnung haben muss, um die Behandlungsinformationen wirksam zu vermitteln. - Compliance und Risikominderung: Die Einhaltung der Kennzeichnungsvorschriften ist nicht nur eine Formalität, sondern eine gesetzliche Verpflichtung. Aufsichtsbehörden wie die US and Drug Administration (FDA), die Europäische Arzneimittelagentur (EMA) und andere schreiben eine genaue und umfassende Kennzeichnung vor. Die Nichteinhaltung kann zu Bußgeldern, einer Schädigung des Markenrufs und sogar zu vorübergehenden Produktionsstillständen führen. Pharmazeutische Unternehmen müssen nachweisen, dass ihre Kennzeichnungsprozesse, -methoden, -tests und -geräte in der Lage sind, konsistent sichere und wirksame Produkte herzustellen. Eine ordnungsgemäß validierte Kennzeichnung mindert Risiken und gewährleistet die Einhaltung der guten Herstellungspraxis (GMP).
- Marktzugang und globale Harmonisierung: Gut strukturierte Etiketten erleichtern den globalen Marktzugang. Eine einheitliche Kennzeichnung in verschiedenen Regionen rationalisiert Prozesse, reduziert Redundanzen und entspricht harmonisierten Standards. Da internationale Regulierungsbehörden GMP-Validierungsanforderungen, einschließlich Serialisierung, einführen, werden pharmazeutische Lieferketten immer komplexer. Unternehmen, die der Einhaltung von Etikettierungsvorschriften Vorrang einräumen, schaffen Vertrauen, erhöhen die Marktakzeptanz und positionieren sich für den Erfolg im Wettbewerb.
Wie sieht das Genehmigungsverfahren für die Kennzeichnung aus?
Das Genehmigungsverfahren für die Etikettierung in der pharmazeutischen Industrie umfasst mehrere Stufen, um sicherzustellen, dass alle arzneimittelbezogenen Informationen korrekt, konform und für Gesundheitsdienstleister und Patienten verständlich sind. Er beginnt mit dem Entwurf des Inhalts des Etiketts, der Details zu Dosierung, Verabreichung, Sicherheit und Warnhinweisen enthält. Dieser Entwurf wird dann intern von den Aufsichtsbehörden und den medizinischen Teams überprüft, um sicherzustellen, dass er mit den lokalen und internationalen Aufsichtsstandards übereinstimmt. Nach der Fertigstellung wird das Etikett den Gesundheitsbehörden zur Genehmigung vorgelegt, wo es einer strengen Prüfung unterzogen wird, um sicherzustellen, dass es den Anforderungen an Sicherheit und Wirksamkeit entspricht. Erst nach Erhalt der offiziellen Genehmigung kann das Etikett für die Vermarktung des Arzneimittels verwendet werden.
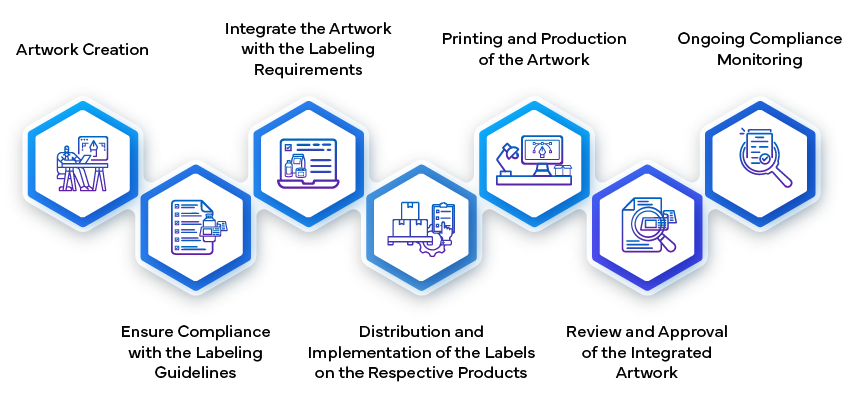
- Erstellen und Einreichen des Etiketts:
- Erste Datenerhebung: Pharmazeutische Unternehmen stellen alle relevanten Daten für das Medikamentenetikett zusammen. Dazu gehören Informationen über Wirksamkeit, Sicherheit, Dosierung, Indikationen, Kontraindikationen und mögliche Risiken. Das Etikett dient als wichtiges Kommunikationsinstrument für Angehörige der Gesundheitsberufe und Patienten.
- Einreichung bei den Aufsichtsbehörden: Das Unternehmen reicht die Etikettendaten bei Aufsichtsbehörden wie der US and Drug Administration (FDA) oder der Europäischen Arzneimittelagentur (EMA) ein. Diese Behörden bewerten die Daten, um sicherzustellen, dass die Vorteile des Arzneimittels für die vorgesehene Bevölkerungsgruppe die bekannten und potenziellen Risiken überwiegen.
- Kontextuelle Analyse: Die Prüfer analysieren das Zielleiden oder die Krankheit, für die das Medikament bestimmt ist. Sie betrachten die bestehende Behandlungslandschaft und wägen die Risiken des Medikaments gegen seinen Nutzen ab. So kann beispielsweise ein Arzneimittel zur Behandlung einer lebensbedrohlichen Krankheit, für die es keine alternative Therapie gibt, zugelassen werden, auch wenn die Risiken bei einer nicht lebensbedrohlichen Krankheit nicht akzeptabel wären.
- Bewertung der klinischen Daten: Die FDA bewerten die vom Arzneimittelhersteller vorgelegten klinischen Nutzen- und Risikodaten. Sie berücksichtigen dabei alle Unsicherheiten, die sich aus unvollkommenen oder unvollständigen Daten ergeben. Normalerweise erwartet die Behörde Ergebnisse aus gut konzipierten klinischen Studien, um die Wirksamkeit und Sicherheit des Arzneimittels zu bestätigen.
- Erstellung des Artwork:
- Sobald der Inhalt des Etiketts genehmigt ist, besteht der nächste Schritt darin, das artwork zu erstellen. Dazu gehören die Gestaltung der visuellen Elemente, des Layouts, der Schriftarten und der Grafiken. Das artwork den gesetzlichen Vorschriften entsprechen und die Informationen auf dem Etikett korrekt wiedergeben.
- Das artwork innerhalb des Pharmaunternehmens intern geprüft, um Konsistenz und Konformität sicherzustellen. Es enthält Angaben wie Dosierungsanweisungen, Warnhinweise, Lagerbedingungen und Kontaktinformationen.
- Das endgültige artwork den Aufsichtsbehörden zur Genehmigung vorgelegt. Dieser Schritt stellt sicher, dass die visuelle Darstellung des Etiketts den Qualitätsstandards entspricht und wichtige Informationen für die Verbraucher klar und deutlich vermittelt.
- Herstellung und Implementierung:
- Nach der Genehmigung artwork das artwork einem integralen Bestandteil der Arzneimittelverpackung. Die Hersteller stellen sicher, dass die Etiketten korrekt auf jeder Produkteinheit (z. B. Flaschen, Blisterpackungen, Fläschchen) angebracht sind.
- Durch Qualitätskontrollverfahren wird überprüft, ob die Etiketten den Spezifikationen entsprechen, einschließlich des genauen Inhalts, der Lesbarkeit und der Einhaltung der Gestaltungsrichtlinien.
- Das Etikett dient als Brücke zwischen dem pharmazeutischen Unternehmen, den Aufsichtsbehörden, den Gesundheitsdienstleistern und den Patienten. Es spielt eine wichtige Rolle bei der Gewährleistung der sicheren und wirksamen Verwendung von Medikamenten während des gesamten Lebenszyklus des Produkts.
Was sind häufige Herausforderungen bei der gesetzlichen Kennzeichnung?
Zu den häufigen Herausforderungen bei der Kennzeichnung von Arzneimitteln gehören die Einhaltung der sich weiterentwickelnden behördlichen Anforderungen, die Verwaltung mehrsprachiger Kennzeichnungen und die Sicherstellung der Konsistenz bei unterschiedlichen Produktportfolios. Die Dynamik der regulatorischen Standards für die Arzneimittelkennzeichnung erfordert ständige Wachsamkeit, um mit den neuesten Anforderungen Schritt zu halten. Die Anpassung an sich ändernde Vorschriften und die unverzügliche Umsetzung notwendiger Aktualisierungen von Inhalt und Format der Kennzeichnung sind für die Einhaltung der Vorschriften und die Gewährleistung der Patientensicherheit unerlässlich.
| Herausforderung | Beschreibung |
|---|---|
| Sich entwickelnde regulatorische Anforderungen | Der Umgang mit sich ständig ändernden Vorschriften und Richtlinien, die eine ständige Aktualisierung der Etikettierungsunterlagen erfordern. |
| Globale Harmonisierung | Gewährleistung der Einheitlichkeit der Produktinformationen in den verschiedenen Regionen, um den unterschiedlichen Anforderungen der verschiedenen Gesundheitsbehörden gerecht zu werden. |
| Integration von Daten nach der Markteinführung | Verwaltung der Einbeziehung von Sicherheits- und Wirksamkeitsdaten nach der Markteinführung in die Etikettierung unter Wahrung von Genauigkeit und Relevanz. |
| Einhaltung lokaler Etikettierungsstandards | Einhaltung der länderspezifischen Etikettierungsstandards unter Berücksichtigung sprachlicher, kultureller und formatierungstechnischer Unterschiede. |
| Effizientes Änderungsmanagement bei der Etikettierung | Rationalisierung der Prozesse für die Nachverfolgung, Umsetzung und Dokumentation von Kennzeichnungsänderungen in kürzester Zeit und Genauigkeit. |
Die mehrsprachige Etikettierung ist eine große Herausforderung für Pharmaunternehmen, die auf globalen Märkten tätig sind. Die genaue Übersetzung von Beschriftungsinhalten in mehrere Sprachen unter Berücksichtigung regionaler sprachlicher und rechtlicher Nuancen erfordert viel Liebe zum Detail und robuste Übersetzungsmanagementprozesse. Die Gewährleistung von Konsistenz und Klarheit in den verschiedenen Sprachversionen ist entscheidend für die effektive Vermittlung wichtiger Informationen an unterschiedliche Patientengruppen.
Eine weitere häufige Herausforderung bei der Kennzeichnung durch die Aufsichtsbehörden ist die Wahrung der Konsistenz zwischen verschiedenen Produktportfolios. Pharmazeutische Unternehmen führen oft mehrere Produkte mit unterschiedlichen Kennzeichnungsanforderungen, Formulierungen und Indikationen. Um Kohärenz und Konformität über verschiedene Produktlinien hinweg zu erreichen und gleichzeitig die spezifischen regulatorischen Anforderungen für jedes Produkt zu erfüllen, sind effiziente Prozesse und Systeme erforderlich, um die Einheitlichkeit des Inhalts, des Formats und der Botschaft der Kennzeichnung zu gewährleisten.
Was sind die wichtigsten Vorschriften für die Kennzeichnung von Arzneimitteln?
Die Kennzeichnung von Arzneimitteln unterliegt einer Reihe komplexer Vorschriften, die die Sicherheit, Wirksamkeit und korrekte Anwendung von Medikamenten gewährleisten sollen. Einige von ihnen sind im Folgenden aufgeführt:
US FDA ArzneimittelbehördeFDA Food and DrugFDA )
Die US FDA die Kennzeichnung von Arzneimitteln durch strenge Vorschriften, die im Code of Federal Regulations (CFR) Title 21 festgelegt sind. Diese Vorschriften verlangen, dass Etiketten umfassende Informationen enthalten, darunter Indikationen, Anwendungshinweise, Kontraindikationen und mögliche Nebenwirkungen. Die FDA die Bedeutung einer klaren, präzisen und eindeutigen Sprache, um die Sicherheit der Patienten und eine fundierte Entscheidungsfindung durch die Gesundheitsdienstleister zu gewährleisten. Darüber hinaus erstrecken sich die Kennzeichnungsvorschriften FDA auf verschiedene Aspekte wie Verpackung, Beipackzettel und elektronische Kennzeichnung, um sicherzustellen, dass alle Informationen zugänglich und in verschiedenen Formaten standardisiert sind. Die Einhaltung dieser Vorschriften ist für die Zulassung von Arzneimitteln und deren weitere Marktpräsenz in den Vereinigten Staaten zwingend erforderlich.
EMA (Europäische Arzneimittelbehörde)
Die EMA überwacht die Kennzeichnung von Arzneimitteln in der Europäischen Union durch Richtlinien und Leitlinien, die die Kennzeichnung in den member states harmonisieren sollen. Im Mittelpunkt dieser Bemühungen steht die Richtlinie 2001/83/EG European Commission , in der die Anforderungen an die Zusammenfassung der ProduktmerkmaleSmPC), die Packungsbeilage und die Verpackungsetiketten festgelegt sind. Die EMA stellt sicher, dass die Kennzeichnung wichtige Informationen für Angehörige der Gesundheitsberufe und Patienten enthält, um eine sichere und wirksame Anwendung von Medikamenten in der gesamten EU (European Union) zu fördern. Darüber hinaus muss die Kennzeichnung in den Amtssprachen der member states , in denen das Arzneimittel vermarktet wird, verfügbar sein, was das Engagement der EMA für Zugänglichkeit und eine patientenorientierte Versorgung widerspiegelt.
TGA (Therapeutic Goods Administration)
In Australien ist die TGA gemäß dem Therapeutic Goods Act 1989 für die Regelung der Arzneimittelkennzeichnung zuständig. Die Richtlinien der TGA schreiben vor, dass die Kennzeichnung von Arzneimitteln klare, genaue und umfassende Informationen über das Produkt, einschließlich seiner Inhaltsstoffe, Indikationen, Dosierung und potenziellen Risiken, enthalten muss. Die Kennzeichnungsvorschriften sollen die öffentliche Gesundheit schützen, indem sie sicherstellen, dass Verbraucher und Angehörige der Gesundheitsberufe über die notwendigen Informationen für eine sichere und wirksame Anwendung von Medikamenten verfügen. Die TGA legt auch großen Wert auf die Lesbarkeit der Etiketten, indem sie vorschreibt, dass sie in einfachem Englisch verfasst sein müssen und dass wichtige Informationen deutlich sichtbar angezeigt werden, um Missbrauch und Medikationsfehler zu vermeiden.
Health Canada
Health Canada regelt die Kennzeichnung von Arzneimitteln in einem Rahmen, der die Sicherheit und das Wohlbefinden von Patienten und Gesundheitsdienstleistern in den Vordergrund stellt. Das Lebensmittel- und Arzneimittelgesetz (Food and Drugs Act) und die zugehörigen Vorschriften legen die Anforderungen an die Kennzeichnung von Arzneimitteln fest, die detaillierte Informationen über die Zusammensetzung des Produkts, Indikationen, Kontraindikationen und mögliche Nebenwirkungen enthalten müssen. Health Canada schreibt außerdem vor, dass die Etiketten zweisprachig sein müssen, d. h. sowohl auf Englisch als auch auf Französisch, um der Sprachenvielfalt des Landes Rechnung zu tragen. Darüber hinaus aktualisiert Health Canada seine Kennzeichnungsvorschriften regelmäßig, um neuen wissenschaftlichen Erkenntnissen und den sich verändernden Bedürfnissen der öffentlichen Gesundheit Rechnung zu tragen und so sicherzustellen, dass die Kennzeichnung weiterhin relevant und wirksam ist, um die sichere Verwendung von Medikamenten zu fördern.
PMDA (Agentur für Arzneimittel und Medizinprodukte)
Die PMDA, Japans Regulierungsbehörde, überwacht die Kennzeichnung von Arzneimitteln in Übereinstimmung mit dem Pharmaceutical Affairs Law und den entsprechenden Richtlinien. Die PMDA verlangt, dass die Kennzeichnung von Arzneimitteln umfassende Informationen, einschließlich Indikationen, Dosierungsanweisungen und mögliche unerwünschte Wirkungen, in einem Format enthält, das sowohl für medizinisches Fachpersonal als auch für Patienten leicht verständlich ist. Die PMDA schreibt außerdem vor, dass die Etiketten Warnhinweise und Vorsichtsmaßnahmen enthalten, die speziell auf die japanische Bevölkerung zugeschnitten sind und Faktoren wie genetische Unterschiede und kulturelle Gepflogenheiten berücksichtigen. Auf diese Weise wird sichergestellt, dass Medikamente in Japan sicher und wirksam verwendet werden, wobei die Kennzeichnung auf die besonderen Bedürfnisse des lokalen Marktes zugeschnitten ist.
NMPA (Nationale Verwaltung für Medizinprodukte)
In China regelt der NMPA die Kennzeichnung von Arzneimitteln durch ein Regelwerk, das den Schwerpunkt auf Genauigkeit, Klarheit und Sicherheit legt. Das Arzneimittelgesetz der Volksrepublik China legt die Anforderungen an die Kennzeichnung von Arzneimitteln fest, die Informationen über die Indikationen, die Dosierung, die Gegenanzeigen und die möglichen Nebenwirkungen des Medikaments enthalten müssen. Das NMPA schreibt auch vor, dass die Beschriftung in vereinfachtem Chinesisch erfolgen muss, um die Verständlichkeit für die lokale Bevölkerung zu gewährleisten. Darüber hinaus schreibt das NMPA vor, dass die Kennzeichnung während des Zulassungsverfahrens streng geprüft wird, um die Einhaltung der nationalen Standards zu gewährleisten und die öffentliche Gesundheit durch die Verhinderung von Medikationsfehlern und -missbrauch zu schützen.
Wie kann ein Regulierungspartner dabei helfen, die Kennzeichnungsvorschriften einzuhalten?
Ein Partner im Bereich Regulierung trägt entscheidend zur Einhaltung der Kennzeichnungsvorschriften bei, indem er spezialisiertes Fachwissen und umfassende Unterstützung bietet. Er begleitet Unternehmen durch die komplexe regulatorische Landschaft und stellt sicher, dass Kennzeichnungsmaterialien – einschließlich Verpackungen, Beipackzetteln und elektronischen Etiketten – den spezifischen Anforderungen verschiedener Gesundheitsbehörden wie der US FDA, EMA, der TGA, Health Canada, PMDA und NMPA entsprechen. Dazu gehört das Verständnis und die Anwendung der neuesten Vorschriften, die sich je nach Region erheblich unterscheiden können, um sicherzustellen, dass alle Produktinformationen korrekt, vollständig und konform sind.
Darüber hinaus trägt ein Partner aus dem Bereich Regulierung dazu bei, den Kennzeichnungsprozess zu optimieren, indem er wichtige Dienstleistungen wie die Erstellung, Überprüfung und Validierung von Inhalten anbietet. Sie helfen bei der Erstellung und Überarbeitung von Kennzeichnungsinhalten, um sie mit den behördlichen Standards in Einklang zu bringen, und stellen sicher, dass alle erforderlichen Informationen enthalten sind, von der Liste der Inhaltsstoffe und den Anwendungshinweisen bis hin zu Sicherheitswarnungen und Lagerbedingungen. Dies verringert das Risiko von Fehlern und Auslassungen, die zu Verzögerungen bei der Zulassung oder zur Rücknahme vom Markt führen könnten, und beschleunigt die Markteinführung neuer Produkte.

Darüber hinaus unterstützt ein Partner aus dem Bereich Regulierung Unternehmen bei der Einhaltung von Vorschriften, indem er Aktualisierungen der Vorschriften überwacht und bei Bedarf Änderungen vornimmt. Sie bieten strategische Beratung bei der Anpassung von Etiketten an neue Richtlinien oder aufkommende Marktanforderungen, helfen Unternehmen, Probleme mit der Einhaltung von Vorschriften zu vermeiden und stellen sicher, dass ihre Produkte mit den aktuellen Vorschriften in Einklang stehen. Indem sie ihr Fachwissen nutzen und mit den Änderungen der Vorschriften Schritt halten, helfen sie den Unternehmen, sich in der dynamischen Landschaft der Etikettierung effizient und effektiv zurechtzufinden.
Wie können Unternehmen mit Regulatory Labeling Services beginnen?
Um mit Regulatory labeling services zu beginnen, sollten Unternehmen zunächst ihren spezifischen Kennzeichnungsbedarf auf der Grundlage der Zielmärkte und der regulatorischen Anforderungen ermitteln. Anschließend sollten sie sich mit einem zuverlässigen Anbieter von Regulierungsdienstleistungen zusammentun, der sich mit den globalen Kennzeichnungsstandards auskennt. Dieser Anbieter kann bei der Erstellung, Überprüfung und Aktualisierung von Etiketten helfen, um die Einhaltung der Vorschriften zu gewährleisten. Darüber hinaus trägt die Implementierung eines zentralen Kennzeichnungsmanagementsystems zur Rationalisierung des Prozesses bei und gewährleistet die Konsistenz aller Produktkennzeichnungen. Regelmäßige Audits und Aktualisierungen sind unerlässlich, um die Etiketten mit den sich weiterentwickelnden Vorschriften in Einklang zu bringen.
Bewertung des Regulierungsbedarfs:
- Ermitteln Sie die spezifischen rechtlichen Anforderungen, die für Ihr Produkt und Ihre Zielmärkte gelten.
- Verstehen Sie wichtige Dokumente, wie z. B. KerndatenblätterCDS), PrüfbroschürenIB und lokale Kennzeichnungsvorschriften.
Wählen Sie einen Partner für die regulatorische Kennzeichnung:
- Recherchieren Sie und wählen Sie einen seriösen Anbieter von Etikettierungsdiensten mit Fachwissen in Ihrer Branche.
- Berücksichtigen Sie Faktoren wie Erfahrung, Kenntnisse über globale Rechtsvorschriften und die Fähigkeit, verschiedene Herausforderungen bei der Etikettierung zu bewältigen.
Definieren Sie den Projektumfang:
- Skizzieren Sie klar und deutlich den Umfang Ihres Projekts zur gesetzlichen Kennzeichnung, einschließlich der Art der erforderlichen Dienstleistungen (z. B. Entwurf von IB , Erstellung von CCDS , Überprüfung der Einhaltung der Kennzeichnungsvorschriften).
- Festlegung von Zeitplänen, Meilensteinen und Leistungen für jede Phase des Projekts.
Arbeiten Sie bei der Datenerfassung zusammen:
- Arbeiten Sie eng mit dem von Ihnen gewählten Partner für die Zulassungskennzeichnung zusammen, um wichtige Daten zu sammeln, einschließlich Informationen aus klinischen Studien, Sicherheits- und Wirksamkeitsdaten sowie Daten aus der Überwachung nach der Markteinführung.
Initiieren Sie die Erstellung und Überprüfung von Dokumenten:
- Beginnen Sie mit der Erstellung oder Überarbeitung wichtiger Dokumente wie IBs, DCDS, CCDS und lokalen Kennzeichnungsinhalten.
- Moderation regelmäßiger Überprüfungen und Feedback-Sitzungen, um Genauigkeit und Übereinstimmung mit den gesetzlichen Anforderungen zu gewährleisten.
Implementierung von Änderungskontrollprozessen:
- Entwicklung robuster Änderungskontrollprozesse für die Kennzeichnung von Aktualisierungen und die unverzügliche Verfolgung von Änderungen an Kerndokumenten.
- Sicherstellen, dass die Änderungen bei allen globalen und regionalen Etiketten einheitlich umgesetzt werden.
Überwachung der Einhaltung:
- Einrichtung von Mechanismen zur laufenden Überwachung der Einhaltung der sich entwickelnden Regulierungsstandards.
- Informieren Sie sich über Änderungen der Vorschriften und aktualisieren Sie die Kennzeichnungsunterlagen entsprechend.
Nutzung von Technologie und Automatisierung:
- Nutzen Sie Software und Technologie für die Kennzeichnung von Vorschriften, um die Genauigkeit, Effizienz und das Dokumentenmanagement zu verbessern.
- Erforschen Sie Tools, die künstliche Intelligenz unterstützen, um die Implementierung und Überprüfung von Datenblättern zu optimieren.
Regulierungsexperten einbeziehen:
- Engagieren Sie Regulierungsexperten oder Berater innerhalb Ihres Unternehmens oder über den von Ihnen gewählten Dienstleister, die Ihnen während des gesamten Kennzeichnungsprozesses Einblicke und Anleitung geben.
Kontinuierliche Verbesserung:
- Schaffung einer Kultur der kontinuierlichen Verbesserung durch regelmäßige Überprüfung und Verfeinerung der Kennzeichnungsprozesse auf der Grundlage von Rückmeldungen, Branchenveränderungen und sich entwickelnden gesetzlichen Rahmenbedingungen.
Können Regulatory Labeling Services bei der Überwachung nach dem Inverkehrbringen hilfreich sein?
Ja, Regulatory labeling services können in der Tat bei der Überwachung pharmazeutischer Produkte nach der Markteinführung helfen. Diese Dienstleistungen spielen eine entscheidende Rolle bei der Unterstützung der Überwachung nach der Markteinführung, indem sie die Verwaltung von Aktualisierungen der Kennzeichnung erleichtern, sicherheitsrelevante Änderungen der Kennzeichnung vornehmen und die Einhaltung der gesetzlichen Anforderungen nach der Zulassung sicherstellen. Durch die Aufrechterhaltung präziser und aktueller Kennzeichnungsinformationen helfen die Regulatory labeling services den Pharmaunternehmen, auf Sicherheitsbedenken zu reagieren und notwendige Änderungen rechtzeitig umzusetzen, um die Einhaltung der Vorschriften und die Sicherheit der Patienten zu gewährleisten.
Darüber hinaus können Regulatory labeling services bei der effizienten Verbreitung aktueller Sicherheitsinformationen an Angehörige der Gesundheitsberufe und Patienten helfen. Im Falle neuer Sicherheitsergebnisse oder veränderter Risikoprofile für pharmazeutische Produkte können die Experten für regulatorische Kennzeichnung dabei helfen, den Inhalt der Kennzeichnung schnell zu aktualisieren, um die neuesten Sicherheitsdaten und regulatorischen Anforderungen zu berücksichtigen. Dieser proaktive Ansatz zur Überwachung nach der Markteinführung und zur Aktualisierung der Kennzeichnung unterstützt die rechtzeitige Weitergabe wichtiger Sicherheitsinformationen an Gesundheitsdienstleister und Patienten und trägt so zu einer verbesserten Pharmakovigilanz und Patientenversorgung bei.
Insgesamt bieten die Regulatory labeling services eine wertvolle Unterstützung bei der Überwachung nach der Markteinführung, indem sie sicherstellen, dass pharmazeutische Produkte während ihres gesamten Lebenszyklus eine genaue und konforme Etikettierung erhalten. Durch die Nutzung des Fachwissens von Regulierungsexperten und effizienter Etikettierungsmanagementprozesse können Unternehmen Sicherheitsaspekte und regulatorische Verpflichtungen nach der Markteinführung wirksam angehen und so zur anhaltenden Sicherheit und Wirksamkeit ihrer Produkte auf dem Markt beitragen.
Warum Freyr wählen?
Ein Jahrzehnt hervorragender gesetzlicher Etikettierung
Über 180 globale Experten für Etikettierungsdienstleistungen
Spezialisiert auf die Erstellung und Verwaltung wichtiger Dokumente
Fachwissen über Broschüren zu Prüfverfahren, Kerndatenblätter und Kerndatenblätter des Unternehmens
Weltweites Engagement für Compliance und Präzision
Nutzt AI (Artificial Intelligence) für eine effiziente regulatorische Navigation
Schnelle Fakten
+
+
+
Häufig gestellte Fragen
KerndatenblätterCDSCore Data SheetsCDS) bieten eine konsolidierte Zusammenfassung wichtiger Arzneimittelinformationen, einschließlich Indikationen, Dosierungen und Sicherheitsprofile. Sie gewährleisten eine konsistente Kommunikation der wesentlichen Details auf den globalen Märkten und erleichtern die Einhaltung der gesetzlichen Vorschriften und eine fundierte Entscheidungsfindung. CDS dienen auch als Referenz für die Erstellung lokaler Produktetiketten.
Was ist der Unterschied zwischen Investigational Brochures (IB) und Company Core Data Sheets (CCDS)?
Untersuchungsbroschüren (IB) enthalten detaillierte Daten zu klinischen Studien und Informationen zur Arzneimittelentwicklung für Forschungszwecke, während Unternehmens-Kerndatenblätter (CCDS) wichtige Sicherheits- und Wirksamkeitsdaten für globale Zulassungszwecke zusammenfassen und als Leitfaden für den Inhalt und die Aktualisierung von Produktinformationen dienen. CCDS zur Erstellung produktspezifischer Produktinformationen für die Marktzulassung verwendet.
Künstliche Intelligenz verbessert die regulatorische Kennzeichnung durch die Automatisierung der Datenanalyse, die Verbesserung der Genauigkeit bei der Erstellung von Inhalten und die Beschleunigung der Dokumentenprüfung. KI-Tools rationalisieren die Kennzeichnungsprozesse und sorgen für Konsistenz bei unterschiedlichen regulatorischen Anforderungen. Sie helfen auch dabei, potenzielle Compliance-Probleme vorherzusehen und zu lösen.
Die mehrsprachige Etikettierung stellt sicher, dass pharmazeutische Produkte für unterschiedliche Patientengruppen zugänglich sind, erfüllt die regionalen gesetzlichen Anforderungen und erhöht die Sicherheit, indem sie klare, verständliche Anweisungen und Warnhinweise in mehreren Sprachen enthält. Dadurch wird das Risiko von Missverständnissen und Fehlern bei der Verabreichung von Arzneimitteln verringert.
Ein zentralisiertes Etikettierungsmanagementsystem koordiniert die Erstellung, Überprüfung und Aktualisierung von Etikettierungsdokumenten und sorgt für Konsistenz und Konformität auf allen globalen Märkten. Es strafft die Prozesse und sorgt für genaue, aktuelle Produktinformationen. Dieses System unterstützt auch die effiziente Bearbeitung von Änderungen der Kennzeichnung und von Aktualisierungen der gesetzlichen Vorschriften.
Structured Product Labeling (SPL) ist ein XML Format für die Kennzeichnung von Arzneimitteln, das die Produktinformationen standardisiert und organisiert. Es gewährleistet Konsistenz und erleichtert den Datenaustausch zwischen Zulassungsbehörden und Herstellern. SPL unterstützt die effiziente Verwaltung von Kennzeichnungsinformationen während des gesamten Lebenszyklus eines Produkts.
Die Global Location Number (GLN) ist eine eindeutige Kennung, die zur Identifizierung von Standorten und Unternehmen innerhalb der Lieferkette verwendet wird. Sie hilft bei der genauen Verfolgung und Verwaltung pharmazeutischer Produkte auf den globalen Märkten. GLNs gewährleisten eine präzise und effiziente Produktverteilung und Bestandsverwaltung.
Der National Drug Code (NDC) ist eine eindeutige Kennung für Arzneimittel, die von der FDA vergeben wird. Er hilft bei der genauen Identifizierung von Arzneimitteln und erleichtert die Bestandsverwaltung und -verfolgung. Der NDC ist entscheidend für die genaue Abgabe von Arzneimitteln und die Berichterstattung an die Behörden.
Eine PrüferinformationIBInvestigator's BrochureIB) enthält detaillierte Informationen über die klinischen und präklinischen Daten eines Prüfpräparats. Sie dient dazu, die Prüfer in klinischen Studien über die Sicherheit, Wirksamkeit und Dosierung des Arzneimittels für Studienzwecke zu informieren. Die IB unterstützt auch die ethische und fundierte Entscheidungsfindung in der klinischen Forschung.












