
Imagine estar a trabalhar num novo medicamento para tratar uma doença devastadora. Após anos de trabalho árduo, finalmente reuniu os dados necessários para enviar uma submissão regulatória à FDA. Mas então, percebe que os seus registos eletrónicos e assinaturas eletrónicas não estão em conformidade com 21 CFR Part 11. Este é um cenário em que ninguém quer se encontrar. O mundo da conformidade regulamentar é complexo e está em constante evolução. Com novas regulamentações sendo introduzidas o tempo todo, pode ser difícil para as empresas acompanharem. No entanto, existe uma regulamentação essencial para qualquer empresa que opera em um setor regulamentado: a norma 21 CFR Part 11.
21 CFR Part 11 um regulamento que estabelece os critérios para registos eletrónicos e assinaturas eletrónicas em indústrias FDA. Ela foi concebida para garantir que os registos eletrónicos sejam confiáveis, seguros e equivalentes aos registos em papel e assinaturas manuscritas. 21 CFR Part 11 relevante para submissões regulatórias, pois fornece orientações para garantir que os registos eletrónicos e as assinaturas eletrónicas estejam em conformidade com FDA . É importante porque os pedidos de regulamentação geralmente contêm uma quantidade significativa de dados eletrónicos, como dados de ensaios clínicos, registos de fabrico e dados de controlo de qualidade.
Aqui estão alguns dos principais benefícios de cumprir a norma 21 CFR Part 11 submissões regulatórias:
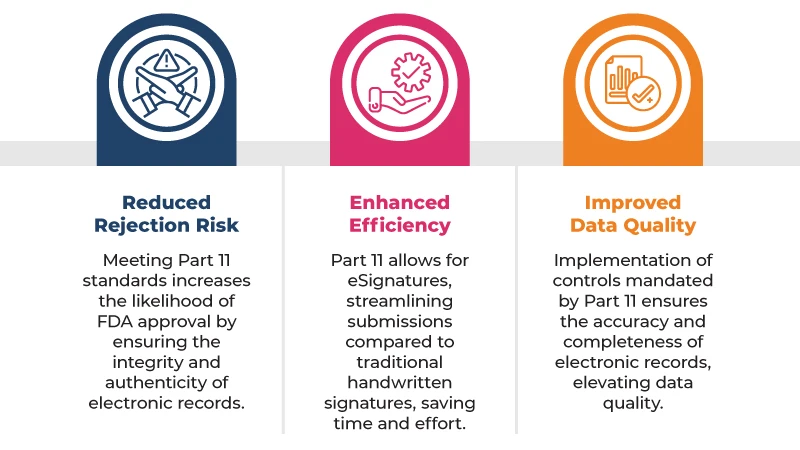
Para cumprir a norma 21 CFR Part 11, as empresas devem implementar uma série de controlos, incluindo:
- Validar sistemas: Assegurar que os sistemas electrónicos cumprem os requisitos da Parte 11, incluindo segurança robusta, pistas de auditoria e testes de integridade dos dados.
- Controlar o acesso dos utilizadores: Restringir o acesso a pessoal autorizado através de proteção por palavra-passe, assinaturas electrónicas e outros métodos de autenticação.
- Manter trilhas de auditoria: Implementar pistas de auditoria para seguir todas as alterações de registos, permitindo a deteção e investigação de alterações não autorizadas.
- Garantir a segurança dos dados: Empregar medidas de segurança dos dados para proteger os registos electrónicos contra o acesso, utilização, divulgação, perturbação, modificação ou destruição não autorizados.
Ao cumprir a norma 21 CFR Part 11, as empresas podem ajudar a garantir que os seus dados clínicos eletrónicos sejam fiáveis e confiáveis. Isso é importante porque FDA tendem a aprovar mais facilmente os pedidos de regulamentação que contêm dados clínicos eletrónicos de alta qualidade.
21 CFR Part 11 é essencial para uma submissão bem-sucedida à FDA. E, com um software de submissão como Freyr PRO, que centraliza a gestão, melhora a colaboração e garante submissões rápidas de eCTD, além de estar 21 CFR Part 11 , você pode alcançar esse objetivo. Para saber mais, solicite uma demonstração agora mesmo!









