
Os envios regulatórios e as tarefas de publicação têm sido tradicionalmente trabalhosos, envolvendo horas de esforços manuais para formatar documentos, gerar PDFs em conformidade com as agências, fazer verificações de qualidade, reunir documentos para envios, etc. Com os prazos exigentes, as empresas de ciências da vida estão sempre apressadas para fazer envios atempados. Em todo o mundo, os órgãos reguladores estão a se preparar para adotar desenvolvimentos recentes, como o eCTD v4.0, para submissões de dossiês, alterações e outros relatórios. O eCTD v4.0 é uma mudança incremental que provavelmente terá impacto no futuro das submissões regulatórias, com todos os países se preparando para aceitá-lo e implementá-lo.
Considerando todos os desafios relacionados com as submissões regulamentares, a necessidade do momento é uma solução tecnologicamente avançada para impulsionar o processo de submissão e revisão de medicamentos. Uma vez que as organizações já estão a considerar a automatização como parte integrante do processo de submissão regulamentar, é crucial considerar como esta pode aumentar a produtividade durante a transição para o eCTD 4.0.
Como é que a automatização ajuda na transição para a eCTD 4.0?
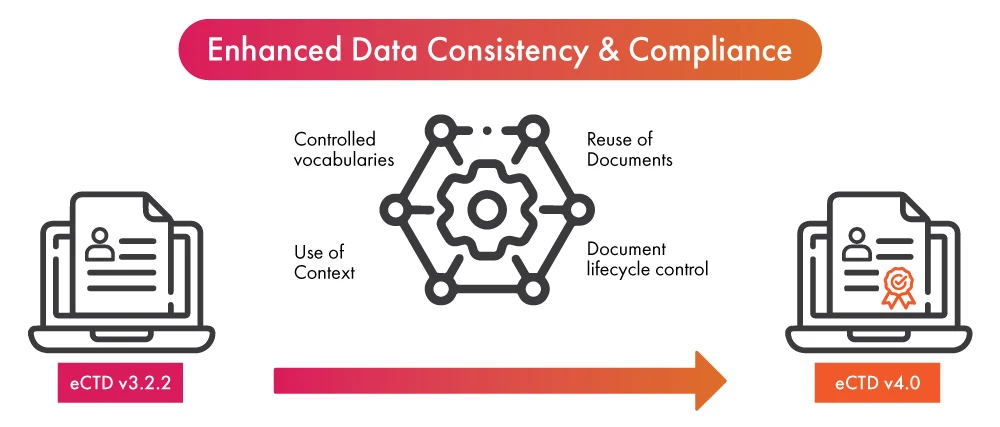
- Na iminência da adoção da última versão da eCTD, a implementação da automatização no processo de submissão regulamentar pode trazer benefícios duplos para as empresas do sector das ciências da vida, que incluem a garantia da conformidade com a eCTD v4.0 num tempo mais rápido, por um lado, e o aumento da consistência dos dados e a simplificação do processo de submissão, por outro.
- Depois de os dados terem sido finalizados para utilização num (01) processo regulamentar, a automatização permite que os dados sejam preenchidos noutras apresentações ou actualizações. Tira partido da nova funcionalidade da eCTD v4.0, que permite agora a substituição de dados muitos-para-um e muitos-para-muitos, permitindo assim a reutilização dos dados de forma simplificada.
- As notificações automatizadas eliminam a necessidade de entregar mensagens ou fazer chamadas telefónicas quando a atividade é necessária. Permite uma comunicação mais rápida e clara, conduzindo a vocabulários controlados, um componente essencial da eCTD v4.0.
- A automatização da apresentação de documentos ajudará a facilitar ainda mais o processo de atualização dos conteúdos já apresentados. Melhorará o controlo do ciclo de vida dos documentos apresentados.
- A automatização em grupos de contexto pode acelerar o processo de organização de múltiplos ficheiros destinados a serem utilizados para submissões regulamentares.
Em meio à transição para o eCTD v4.0, é crucial que as organizações da área de ciências da vida façam parcerias com fornecedores que estejam preparados para o novo padrão e entendam como automatizar e otimizar o processo de publicação regulatória. As empresas precisam se preparar para adotar as tecnologias mais recentes possibilitadas pela automação para obter benefícios proeminentes e uma vantagem competitiva no mercado. O eCTD v4.0 é uma grande mudança que ocorreu após um longo tempo. As organizações precisam de iniciar a sua prova de conceito para testar as águas, uma vez que em breve será aceite em muitos países em todo o mundo, dependendo dos prazos de cada país.
Na Freyr na vanguarda da inovação tecnológica e estamos preparados para apoiar os nossos clientes com o nosso software de submissão e publicação regulamentar -Freyr PRO eCTD v4.0.
Para saber mais sobre a preparação Freyrpara o eCTD 4.0,clique aqui para descarregar a sessão arquivada do webinar.









