
Assuntos Regulamentares RA) desempenham um papel fundamental na garantia da segurança, eficácia e qualidade dos medicamentos no dinâmico panorama farmacêutico. RA Química, Fabricação e Controlo (CMC) RA essenciais para a conformidade. O seu objetivo é proteger a saúde dos pacientes e promover a confiança do público nos produtos farmacêuticos, garantindo a consistência e a qualidade em todo o processo de fabricação de medicamentos.
RA CMC RA os requisitos de documentação e conformidade relacionados com o fabrico, controlo de qualidade e estabilidade dos produtos farmacêuticos. Envolve atenção aos detalhes e adesão às diretrizes regulamentares ao longo de todo o ciclo de vida do desenvolvimento do medicamento. Para saber mais sobre a importância da CMC RA,consulte os nossos especialistas.
Neste blog, vamos aprofundar os fundamentos da CMC RA explorar a sua importância para alcançar a conformidade e manter padrões de alta qualidade.
O papel da CMC desenvolvimento de medicamentos
CMC começam no início do processo de desenvolvimento do medicamento e continuam ao longo de todas as etapas, desde a investigação pré-clínica até a comercialização. CMC e a documentação CMC são componentes essenciais dos pedidos de regulamentação, tais como pedidos de Investigação de Novo Medicamento (IND), Pedidos de Novo Medicamento (NDA) e Autorização de Introdução no Mercado (MAA). As autoridades regulatórias analisam CMC para avaliar a segurança, identidade, potência e qualidade de um medicamento, bem como a confiabilidade e consistência do processo de fabricação.
Garantindo a conformidade com CMC RA
A conformidade com os requisitos CMC é fundamental para uma entrada bem-sucedida no mercado. Autoridades regulatórias como a Food and Drug Administration (USFDA) dos Estados Unidos, a Agência Europeia de Medicamentos (EMA) e outras autoridades sanitárias regionais (HAs) são responsáveis por estabelecer diretrizes e normas que devem ser seguidas. Essas diretrizes abrangem vários aspetos, incluindo práticas de fabricação, sistemas de qualidade, métodos analíticos, testes de estabilidade e validação. A conformidade envolve documentação meticulosa, adesão às Boas Práticas de Fabricação (GMP) e implementação de Sistemas de Gestão da Qualidade (QMS) eficazes.
O papel da CMC no sucesso de uma empresa farmacêutica
Manter altos padrões de CMC oferece várias vantagens às empresas farmacêuticas. Alguns dos principais benefícios são:
- Atenuação dos riscos regulamentares.
- Apoiar o êxito das aprovações regulamentares.
- Reduzir a probabilidade de retirada de produtos do mercado.
- Promover uma reputação positiva de qualidade e fiabilidade.
Pontos a ponderar para o sucessoCMC RA CMC :
- Manter-se atualizado com o conhecimento regulatório: Os requisitos regulatórios em evolução das autoridades regulatórias exigem que se mantenha atualizado com as diretrizes mais recentes. O monitoramento contínuo das atualizações regulatórias e a sua incorporação nas CMC são cruciais para manter a conformidade.
- Estabelecimento de sistemas de qualidade: Isso inclui desenvolver e manter Standard Operating Procedures (SOPs) abrangentes, procedimentos de controlo de documentos, processos de controlo de alterações e programas de formação para garantir que os funcionários compreendam e sigam os protocolos estabelecidos.
- Avaliação e atenuação dos riscos: As empresas devem identificar os riscos potenciais ao longo dos processos de desenvolvimento e fabrico de medicamentos e aplicar estratégias adequadas de atenuação dos riscos. Isto inclui a avaliação dos parâmetros críticos do processo, a variabilidade das matérias-primas, as impurezas potenciais e os riscos da cadeia de abastecimento, que garantem a conformidade.
- Documentação e integridade dos dados: A manutenção de documentação exacta e completa é essencial para demonstrar a conformidade. As empresas devem estabelecer práticas de documentação sólidas, incluindo a manutenção de registos de lotes, dados analíticos, estudos de estabilidade e relatórios de validação. Garantir a integridade, a rastreabilidade e a segurança dos dados é fundamental para evitar problemas de conformidade.
- Gestão eficaz da mudança: As empresas devem ter procedimentos de controlo de alterações bem definidos para avaliar e documentar as alterações, avaliar o seu impacto na qualidade do produto e na conformidade regulamentar e obter as aprovações necessárias antes de implementar as alterações.
- Parcerias e gestão sólidas com fornecedores:Isso envolve a seleção de fornecedores qualificados, a realização de auditorias e o estabelecimento de acordos de qualidade que definam responsabilidades e expectativas. É essencial realizar avaliações regulares da conformidade dos fornecedores com os requisitos atuais de BPF (cGMP).
- Preparação para auditorias e inspecções: As empresas devem efetuar auto-avaliações para identificar áreas de melhoria e garantir a preparação para auditorias regulamentares. De facto, abordar prontamente as conclusões das auditorias e implementar acções corretivas é fundamental para manter a conformidade.
- Melhoria contínua: Isto pode ser conseguido encorajando o envolvimento dos funcionários, fornecendo formação e educação sobre os requisitos regulamentares e promovendo uma mentalidade orientada para a qualidade a todos os níveis da organização.
- Abordagem das Acções Corretivas e Preventivas (CAPA): Ao abordar sistematicamente a não-conformidade utilizando a metodologia CAPA, as empresas farmacêuticas podem demonstrar o seu empenho na melhoria contínua e na conformidade.
- Conhecimento das alterações regulamentares pós-aprovação: Compreender os requisitos regulamentares para alterações pós-aprovação é essencial para garantir a conformidade. A implementação de processos de gestão de alterações adequados e a comunicação eficaz com os HAs podem ajudar a navegar nestas alterações, garantindo a conformidade.
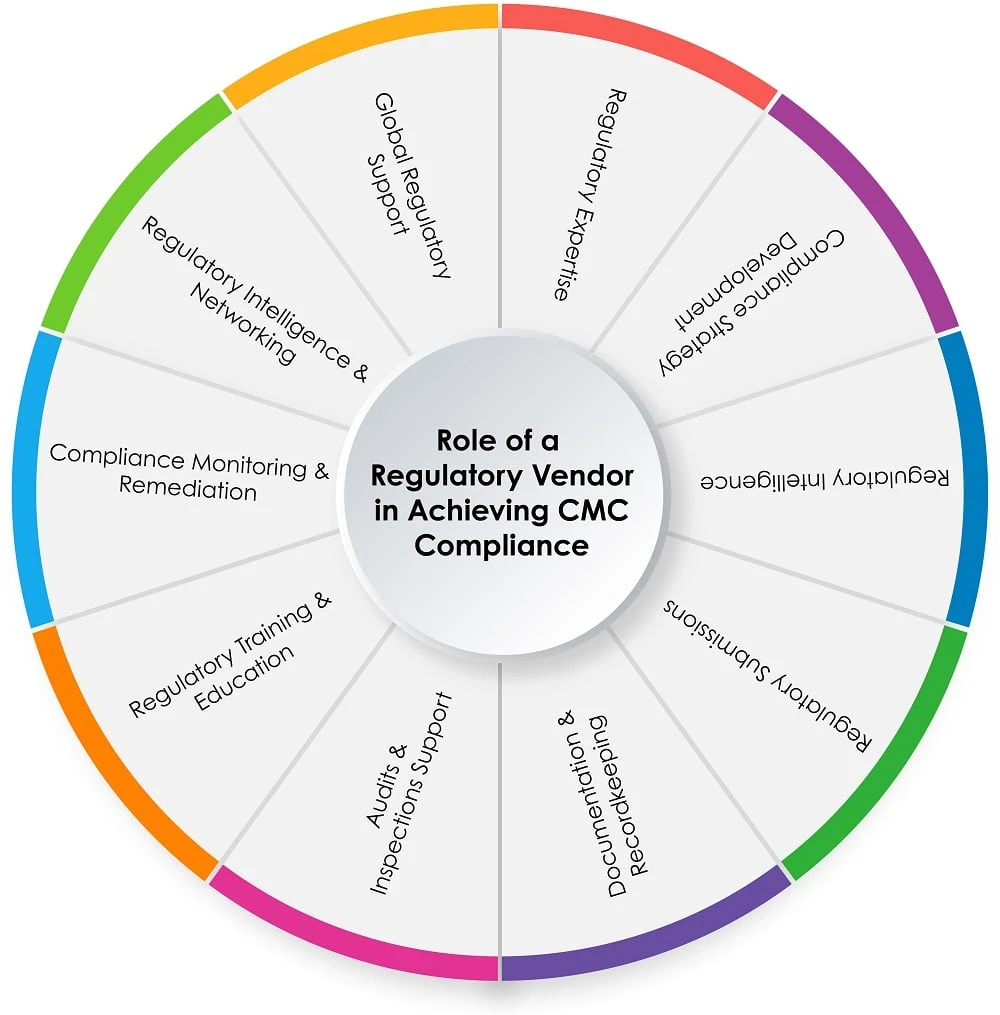
Papel de um fornecedor regulatório no processo CMC
O gráfico circular abaixo (Figura 1) mostra o papel de um fornecedor regulatório no processo CMC :
Figura 1: Papel de um fornecedor regulatório na obtenção CMC
Conclusão
Alcançar e manter a conformidade com CMC exige uma abordagem estratégica, que envolve colaboração multifuncional, sistemas de qualidade robustos e inteligência regulatória (RI) contínua. Também é essencial para o acesso bem-sucedido ao mercado e a disponibilidade contínua do produto. Uma compreensão profunda dos fundamentos da CMC RA a implementação de estratégias de conformidade eficazes podem ajudar as empresas farmacêuticas a navegar pelo panorama regulatório, obter aprovações e manter os mais altos padrões de qualidade e segurança do paciente.Parcerias regulatóriasestratégicas podem sinergizar essas etapas cruciais, oferecendo a melhor experiência da categoria para manter a conformidade.Entre em contacto uspara saber mais sobre os nossos serviços!









