
Além de preencher os xEVMPD exigidos, as organizações da área de ciências da vida agora precisarão usar um submissão baseado na web chamado Digital submissão Integration (DADI). A Agência Europeia de Medicamentos (EMA) projetou o DADI como um substituto de longo prazo para o submissão eletrônico (eAF) baseado em PDF, que foi criado para dar suporte às submissões eCTD.
Os prazos para essa transição foram divulgados recentemente pela EMA. O DADI substituirá o formulário para variações de Medicamentos ano de 2022. Outros formulários de submissão para Produtos Autorizados Centralmente (CAP) e Produtos Autorizados Nacionalmente (NAP) serão substituídos em 2023. O projeto também substituirá os formulários utilizados para os principais procedimentos da UE, incluindo o Procedimento Centralizado (CP), o Procedimento de Reconhecimento Mútuo (MRP), o Procedimento Descentralizado (DCP) e o Procedimento Nacional (NP).
Os formulários web (incluindo o Formulário de Variações Humanas (HVF) para Medicamentos a seres humanos) uniformizarão as entradas para os eAFs, a fim de fornecer dados mestre padrão para Medicamentos. Eles permitirão tanto a saída legível por humanos quanto a nova saída legível por máquinas para processamento digital, com base no padrão de troca de dados Fast Healthcare Interoperability Resources (FHIR) para Medicamentos. Eles também usarão os dados mestre de produtos existentes dos Serviços de Gestão de Produtos (PMS) para preencher previamente os campos do formulário, sempre que aplicável.
Os formulários online da DADI têm como objetivo permitir um processamento mais metódico das submissão, reduzindo assim a carga de trabalho da organização. Por exemplo, os erros e as discrepâncias serão reduzidos, pois os formulários permitem o escrutínio das candidaturas apresentadas pelas autoridades sanitárias. Os formulários também facilitarão a introdução de dados «corretos à primeira tentativa» nas bases de dados, tornando assim mais fácil a integração dos sistemas e a partilha de dados entre as autoridades sanitárias. Além disso, os novos formulários substituirão a tecnologia arcaica.
Vantagens da DADI
O objetivo da DADI e desta transformação dos processos de regulamentação com base em dados pode ser resumido da seguinte forma:
- Aumentar a eficiência das funções de regulamentação, I&D e fabrico
- Comunicar com as autoridades de saúde de forma mais rápida
- Permitir a tomada de decisões com base em dados, tanto para as empresas como para as autoridades
- Para ter uma melhor perceção e previsão dos resultados comerciais e do desempenho global
Em termos globais, este objetivo é benéfico para os doentes, as entidades reguladoras e o sector.
Últimas alterações na cronologia pela EMA
- A data de arranque dos HVFs foi adiada para outubro de 2022, em relação ao calendário anteriormente decidido para abril de 2022.
- Atualmente, a HVF está a ser submetida a testes de aceitação do utilizador (UAT) por um grupo constituído por especialistas na matéria da DADI.
- Posteriormente, será realizado um teste de avaliação integrado com um grupo mais alargado de várias partes interessadas no segundo trimestre de 2022.
- Após a sua entrada em funcionamento, haverá uma fase de transição de seis (06) meses durante a qual serão aceites em paralelo os formulários electrónicos (antiga versão em PDF) e os formulários baseados na Web. Após esta fase, apenas o HVF será aceite.
Consulte o infográfico a seguir para observar os prazos para a implementação do HVF (atualizado em fevereiro de 2022, sujeito a alterações pela EMA):
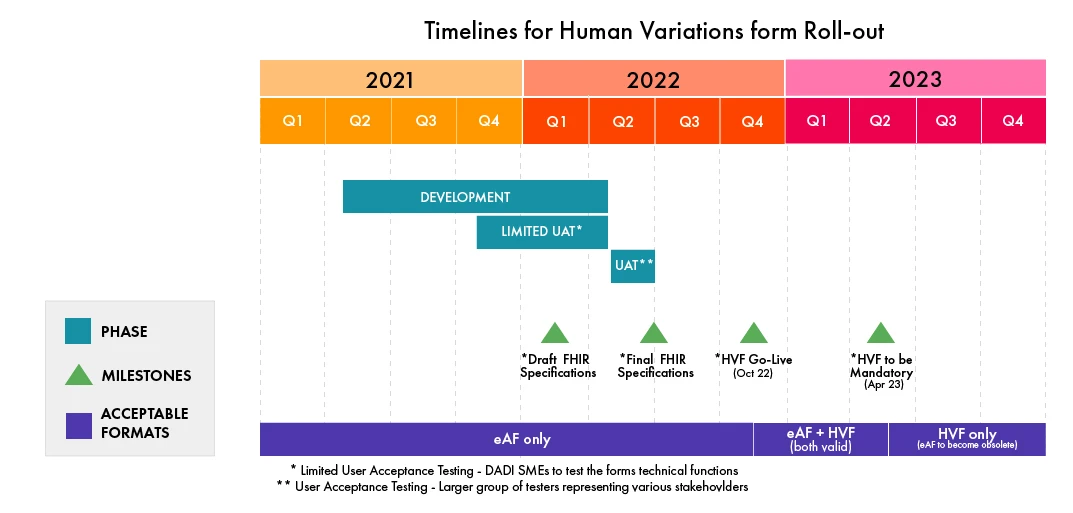
(fonte: EMA)
Assegurar a adaptabilidade ao ambiente regulamentar dinâmico
Todas as principais autoridades de saúde estão agora a avançar para a apresentação de conjuntos de dados e documentos de elevada qualidade. É importante que as organizações mantenham os mesmos num sistema unificado.
É também crucial ter uma compreensão clara de todo o ciclo de vida da apresentação - os seus requisitos, as pessoas e os processos a ela associados, e o local atual dos dados de origem através de uma avaliação exaustiva das necessidades. A limpeza e o enriquecimento dos dados devem ser considerados prioritários se a avaliação indicar uma necessidade.
É imperativo ter um Sistema de Gestão de Informações Regulatórias (RIMS) que se adapte às regulamentações e diretrizes em evolução e que também seja flexível para remodelar as necessidades atuais da organização e estar em conformidade com o ambiente regulatório dinâmico. Para saber mais sobre o conjunto de soluções regulatórias Freyr, que deixarão a sua organização pronta para o DADI e outras alterações de processo semelhantes, us Freyr .









