
Em 9 de fevereiro de 2022, a Agência Europeia de Medicamentos (EMA) iniciou a criação de um Centro de Coordenação para Análise de Dados e Rede de Integração do Mundo Real (DARWIN EUsup). Este é o primeiro passo para integrar as Evidências do Mundo Real (RWE) na avaliação de medicamentos em toda a União Europeia (UE). Garantir a segurança e a eficácia dos medicamentos é a principal atividade de qualquer agência reguladora, e as RWE estão a provar ser uma fonte fiável para a recolha de evidências em tempo real a partir de bases de dados globais de cuidados de saúde. Portanto, esta medida da EMA melhorar a qualidade dos medicamentos na região da UE e torná-los disponíveis mais rapidamente.
Principais atividades planeadas para o Centro de Coordenação do DARWIN EU®
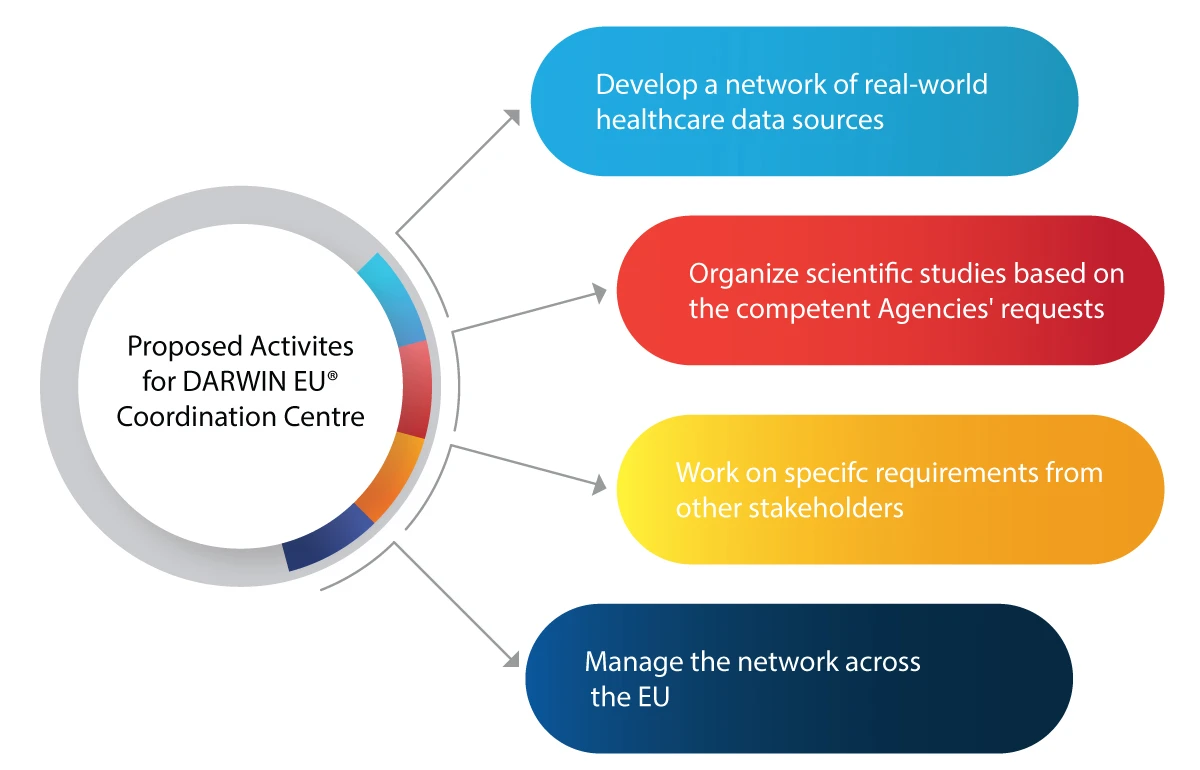
Como é que o DARWIN EU® vai ajudar EMA as autoridades competentes no domínio regulamentar?
Medicamentos inovadores que estejam prontamente disponíveis para os pacientes são uma necessidade urgente. Os processos regulatórios para o desenvolvimento, aprovação, comercialização e Vigilância Pós-Comercialização um tempo considerável, fazendo com que a demanda por novos medicamentos não seja atendida. Reduzir o tempo de comercialização e, ao mesmo tempo, garantir a segurança, eficácia e qualidade dos medicamentos inovadores é o caminho a seguir. Várias autoridades sanitárias globais estão a identificar os benefícios da integração da RWE nas suas aprovações regulatórias, e a DARWIN EU® é a iniciativa EMA.
EMA conectar a rede regulatória europeia de medicamentos ao Espaço Europeu de Dados de Saúde (EHDS) para melhorar o intercâmbio de dados e o acesso a vários tipos de dados de saúde no âmbito deste programa. Também estabelecerá padrões para avaliações científicas e tomada de decisões regulatórias.
Aqui estão algumas atividades que o DARWIN EU® pretende realizar:
- Utilização da RWE em actividades de tomada de decisões para a regulamentação de novos medicamentos, vacinas, etc.
- Integrar a RWE em todo o ciclo de vida de um medicamento, como desenvolvimento, autorização e vigilância pós-comercialização
- Preparar-se para quaisquer emergências médicas futuras, como pandemias
- Beneficiar a indústria farmacêutica com RWE perspicaz e fiável sobre doentes, doenças e utilização de medicamentos
- Tomar decisões regulamentares informadas com base na RWE para uma utilização segura e eficaz dos medicamentos
- Melhoria da acessibilidade dos medicamentos que salvam vidas aos doentes necessitados, graças a uma análise de dados exacta e atempada
Prazos propostos para que a DARWIN EU® se torne uma rede totalmente funcional na UE
A EMA especifica os prazos para que o DARWIN EU® esteja totalmente operacional, que são os seguintes:
- 2021 - Início do projeto
- 2022 – Criação da DARWIN EU®
- 2023 – Desenvolvimento do DARWIN EU® e definição das suas utilizações
- 2024 – Tornar o DARWIN EU® totalmente operacional
- 2025 - Melhorar as utilizações regulamentares dos dados relativos aos cuidados de saúde, aumentando os âmbitos em termos de medicamentos, geografia, etc.
A EMA colaborar com o Centro Médico Universitário Erasmus de Roterdão para a criação do DARWIN EU®. O objetivo desta parceria é a criação de um Centro de Coordenação para criar uma rede de dados distribuída. Ambas as entidades assumiram também as tarefas de realizar estudos científicos, apoiar os processos de tomada de decisão regulamentar e gerir um catálogo de fontes de dados do mundo real.
O que significa o lançamento do DARWIN EU® para o futuro?
A EMA o Head of Medicines Agencies (HMA) sempre trabalharam em conjunto para identificar os desafios, definir metas com prazos e estabelecer prioridades nos seus documentos estratégicos quinquenais. O objetivo é fornecer orientação estratégica para as atividades realizadas pela rede europeia de regulamentação de medicamentos.
O lançamento do DARWIN EU® é um passo importante para a concretização da Estratégia de Rede EMA. Os principais objetivos são a realização de estudos científicos para responder a questões de investigação, o apoio à avaliação de medicamentos na UE e a manutenção metadata atividades regulamentares no domínio dos medicamentos. O DARWIN EU® deverá desempenhar um papel importante na regulamentação dos medicamentos na Europa, e os estudos-piloto deverão estar concluídos até ao final de 2022.
Se é fabricante de medicamentos e deseja saber mais sobre RWE e como ela está a moldar o futuro da tomada de decisões regulatórias, entre em contacto com a Assuntos Regulamentares da Freyr.









