
A Therapeutic Goods Administration (TGA) na Austrália tem regras rigorosas para o registo de novos medicamentos sujeitos a receita médica com novos ingredientes activos. Recentemente, a TGA apresentou um processo revisto para melhorar a eficácia dos medicamentos sujeitos a receita médica que salvam vidas e disponibilizá-los aos doentes mais rapidamente. Estas alterações são pertinentes para os pedidos que têm de ser apoiados por dados não clínicos, clínicos e/ou de bioequivalência (categoria 1 e categoria 2). A TGA publicou um documento em agosto com pormenores sobre os requisitos regulamentares para o mesmo.
Caraterísticas importantes do novo processo de registo de medicamentos sujeitos a receita médica
- A TGA criou um processo de registo por fases e designou as etapas como marcos. Cada uma delas segue um percurso distinto.
- O novo processo visa melhorar a qualidade dos dossiês. Os dossiês são preparados com base num formato de documento técnico comum (CTD) e seguem todos os requisitos regulamentares.
- A fase de planeamento pré-submissão é importante, pois os requerentes apresentam os detalhes da submissão prevista. Isso é feito pelo menos dois meses e um quarto (02 ¼) antes da submissão do dossiê completo. Esta etapa tem como objetivo ajudar a TGA a definir as datas dos marcos subsequentes e preparar os recursos para gerir o CTD.
- A fase seguinte é a apresentação. Uma vez concluída, a TGA não permite que o requerente apresente quaisquer dados ou informações adicionais após a data de apresentação. É obrigatório apresentar um dossiê completo, correto e de alta qualidade.
- Nos termos da secção 31 do Therapeutic Goods Act 1989, a TGA solicita informações adicionais na fase de avaliação. Após a avaliação inicial, todos os pedidos são recolhidos e enviados ao requerente.
Para compreender as etapas do processo de renovação, consulte os seguintes fluxogramas.
Marco 1
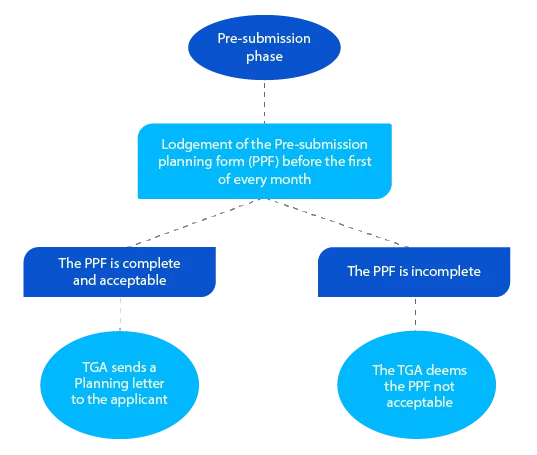
A carta de planeamento contém a data prevista em que a TGA espera o envio do dossiê e outras datas-chave para submissão do medicamento sujeito a receita médica.
Marco 2
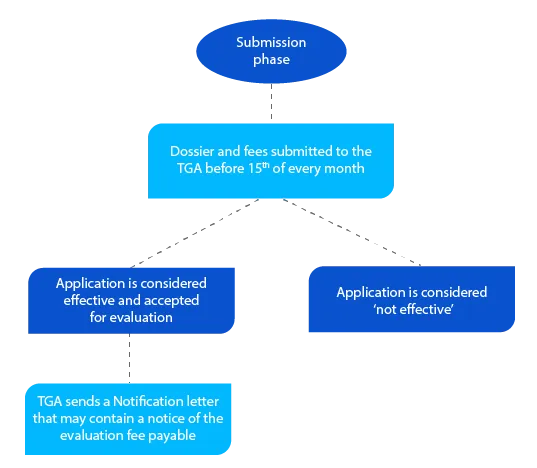
O dossiê contém informações que ajudam a TGA a avaliar a submissão e, se tudo estiver aceitável, uma carta de notificação é enviada antes do final do mês em que o requerente apresentou o dossiê.
Marco 3
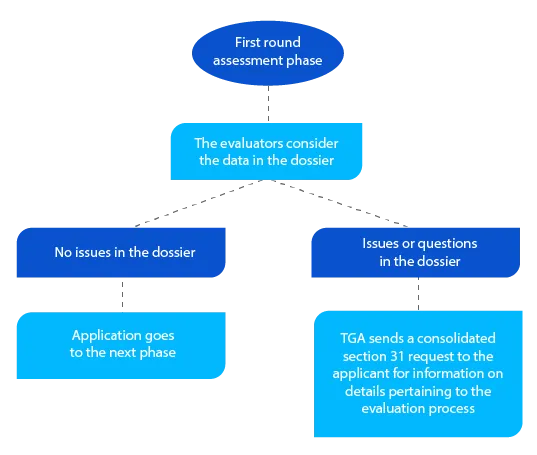
Para além do pedido consolidado da secção 31, sempre que aplicável, a TGA envia cópias dos relatórios de avaliação elaborados pelos avaliadores da qualidade, não clínicos, clínicos e dos Planos de Gestão de Riscos (PGR).
Marco 4

O requerente pode indicar o prazo de resposta da secção 31. Pode ser de trinta (30) ou sessenta (60) dias e deve ser destacado no PPF. Este período tem de ser confirmado pela TGA na carta de planeamento. O formato de resposta aceitável é o CTD, que deve ser enviado sob a forma de cópias impressas e electrónicas.
Uma vez que esta é a última oportunidade para o requerente fornecer quaisquer informações em falta à TGA, tem de o fazer em conformidade.
Marco 5
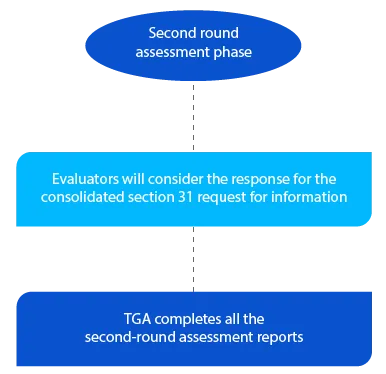
A TGA tem dois (02) meses para os pedidos de novos medicamentos genéricos para a segunda ronda de relatórios de avaliação e um (01) mês para todos submissão outros submissão . Os relatórios são enviados aos respetivos requerentes após a conclusão da segunda avaliação.
Marco 6
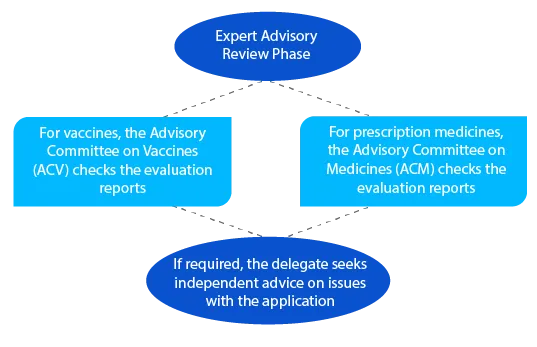
Após o exame consultivo, a TGA envia uma notificação com informações pormenorizadas sobre o parecer que recebeu do ACV ou do ACM.
Marco 7
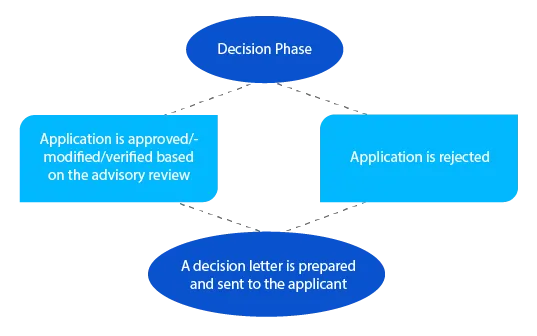
Em caso de questões pendentes, o delegado pode entrar em contacto com o requerente nesta fase antes de tomar uma decisão. No caso dos pedidos apresentados ao abrigo da secção 23 da Lei dos Produtos Terapêuticos de 1989 (medicamentos incluídos na lista de medicamentos recentemente avaliados no Registo Australiano de Produtos Terapêuticos (ARTG)), é enviada uma notificação ao requerente no prazo de vinte e oito (28) dias após a tomada de decisão.
Marco 8
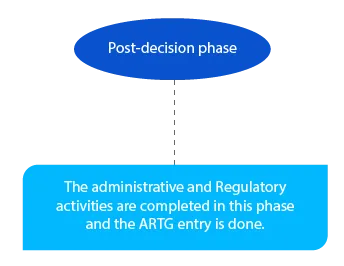
Os pagamentos pendentes são tratados nesta fase. E tem de estar concluída até ao final do mês seguinte à decisão do delegado.
Com a TGA tomando todas as precauções para garantir a segurança, eficácia e qualidade dos medicamentos sujeitos a receita médica, ao mesmo tempo em que reduz o tempo de comercialização, cabe ao requerente apresentar as informações relevantes para um processo de registo tranquilo. Seja em qualquer fase, a situação ideal é colaborar com um prestador de serviços end-to-end , especialista no registo de medicamentos sujeitos a receita médica. Entre em contacto com uma entidade regulatória experiente para obter um caminho compatível; mantenha-se atualizado e em conformidade.









