
A necessidade médica não atendida (UMN) é uma das prioridades mais urgentes dos sistemas de saúde. A constante evolução da ciência e da tecnologia na área da saúde tem proporcionado o potencial para explorar várias opções terapêuticas. As autoridades sanitárias incentivam terapias inovadoras que prometem benefícios significativos para a qualidade de vida dos pacientes. Com base na priorização da inovação e no foco nas necessidades não atendidas dos pacientes para o desenvolvimento de medicamentos, a Agência Europeia de Medicamentos (EMA) introduziu o caminho PRIority MEdicines (PRIME) em 2016. Desde então, o percurso PRIME tem sido um método para conceder aprovações para terapias inovadoras num prazo acelerado. Este tipo de percurso facilitado pode ser explorado por qualquer empresa, desde start-ups a empresas de biotecnologia de média dimensão e grandes organizações multinacionais. No entanto, a qualificação para o percurso é limitada a produtos em desenvolvimento e que ainda não solicitaram uma Autorização de Introdução no Mercado do procedimento centralizado. Os critérios de qualificação são aplicados de forma rigorosa. Entre março de 2016 e abril de 2022, apenas 24% dos pedidos receberam aprovação, enquanto 72% dos pedidos PRIME foram rejeitados. Dos 24% selecionados para o caminho PRIME, a maioria pertencia à área terapêutica da oncologia.
Os inovadores que buscam autorizações de comercialização de medicamentos para doenças raras ou órfãs muitas vezes têm conjuntos de dados limitados disponíveis como evidência para apoiar os seus pedidos de novos medicamentos, conforme exigido pelos reguladores. Os pedidos de Medicamentos de Terapia Avançada Medicamentos ATMPs) e medicamentos órfãos geralmente enfrentam esses desafios. Devido aos dados limitados sobre a população de pacientes, é recomendável uma interação constante com os reguladores para permitir melhores insights para a revisão científica e os requisitos de aprovação. O caminho PRIME pode ser útil para tais terapias devido ao envolvimento precoce dos reguladores no fornecimento de apoio proativo e orientação para a recolha de dados e avaliação de benefícios e riscos.
Méritos de seguir a via PRIME
- Ajuda os inovadores a desenvolver um plano de desenvolvimento bem elaborado.
- Beneficia os inovadores ao envolver as Autoridades de Saúde na fase inicial de desenvolvimento, o que contribui para a elaboração de pedidos de autorização de comercialização de elevada qualidade.
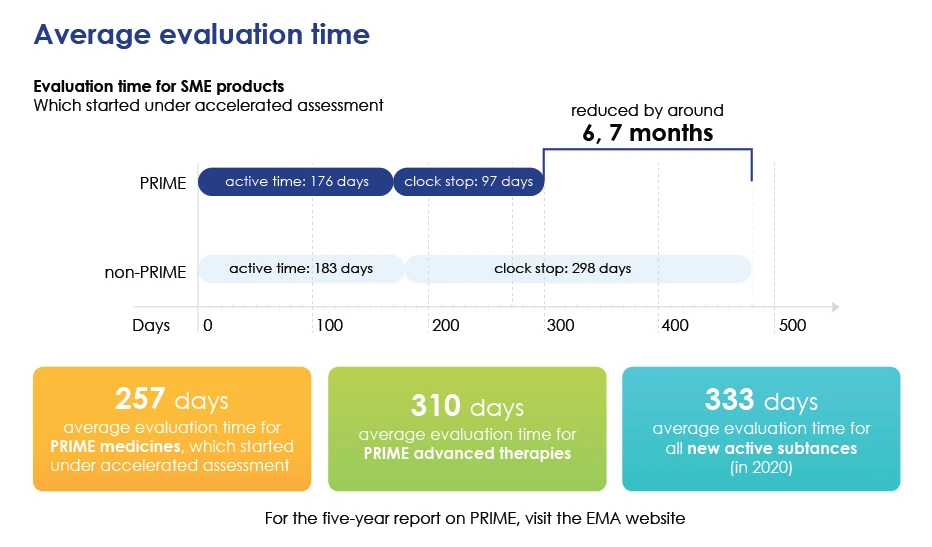
- Acelera a avaliação global, reduzindo o tempo médio de avaliação, para que os medicamentos possam reach mais rapidamente reach .
- Apoia os inovadores a concentrarem a sua atenção no desenvolvimento de medicamentos para melhorar os resultados dos doentes e responder a necessidades não satisfeitas dos doentes.
Tempo de avaliação em pormenor
Candidaturas ao PRIME Pathway
O processo PRIME prioriza necessidades médicas não atendidas. Das 384 solicitações PRIME recebidas desde março de 2016, apenas 18 chegaram à Autorização de Introdução no Mercado junho de 2021.

Está preparado para o PRIME?
A existência da via PRIME deve-se a necessidades médicas significativas não satisfeitas e ao facto de a Rede Europeia de Regulamentação dos Medicamentos (REM) se concentrar em colmatar as lacunas. Para avaliar a adequação de um produto à via PRIME, é necessário considerar o seguinte
- Conclusões: Os candidatos devem indicar a necessidade médica não satisfeita e apresentar um argumento convincente sobre a forma como o seu produto abordará a questão.
- Potencial: Os candidatos devem demonstrar o potencial benéfico da terapia nos critérios de necessidade médica não satisfeita.
- Dados pré-clínicos: Os requerentes devem apresentar alguns dados sobre a eficácia ou o desempenho da terapêutica no sistema biológico humano. Os modelos não clínicos, por muito precisos que sejam, não fornecem uma visão exacta do seu comportamento no sistema biológico humano.
- Fase de desenvolvimento: O requerente deve identificar a fase adequada para entrar no processo PRIME, a fim de obter a melhor orientação possível das entidades reguladoras e prosseguir com a submissão.
Afixar a subvenção PRIME
Assim que um requerente tiver obtido a oportunidade de entrar na via facilitada, a EMA :
- Designar um relator do Comité dos Medicamentos Uso Humano (CHMP) ou do Comité das Terapias Avançadas (CAT), no caso das terapias avançadas.
- Organizar uma reunião inicial com o relator do CHMP/CAT e um grupo multidisciplinar de peritos para fornecer orientações sobre o plano global de desenvolvimento e a estratégia regulamentar.
- Atribuir um ponto de contacto único para o candidato.
- Fornecer aconselhamento científico em cada etapa fundamental do desenvolvimento, envolvendo um conjunto adicional de partes interessadas, como os organismos de avaliação das tecnologias da saúde - para acelerar o acesso dos doentes ao novo medicamento.
- Confirmar o potencial para avaliação acelerada no momento da submissão Autorização de Introdução no Mercado.
submissão sua submissão o caminho da Medicina Prioritária (PRIME) está pronta? Entre em contacto com Freyr hoje mesmo e avalie. Saiba mais sobre como podemos ajudar com a sua estratégia regulatória e designação do caminho PRIME. Mantenha-se informado. Mantenha-se em conformidade.









