
A adoção do eCTD 4.0 representa um passo crucial para a modernização dos envios regulatórios em todo o mundo. Com benefícios como rastreamento aprimorado de documentos e eficiências metadata, não é surpresa que as agências globais estejam a adotar essa mudança.
Mas qual é EMA ? Ao contrário da FDA, que delineou fases de implementação claras, EMA adotar uma abordagem mais cautelosa, começando com programas-piloto e avaliações técnicas. Neste blog, detalhamos os planos EMApara o eCTD 4.0, o seu potencial impacto nos registos regulamentares e como a sua empresa pode manter-se à frente.
Mais importante ainda, EMA já EMA o eCTD 4.0? Vamos aprofundar o assunto.
O que é a eCTD 4.0 e quais são as suas diferenças em relação à eCTD 3.2.2?
O Documento Técnico Comum Eletrónico (eCTD) é o formato internacionalmente aceite para as apresentações regulamentares. Normaliza a forma como as empresas farmacêuticas apresentam pedidos de medicamentos e gerem as actualizações do ciclo de vida em diferentes mercados.
A versão atual, eCTD 3.2.2, está em uso há anos. No entanto, órgãos reguladores, incluindo EMA, têm trabalhado no desenvolvimento do eCTD 4.0, que se baseia no padrão Health Level 7 (HL7) Regulated Product Submission (RPS). Essa atualização melhora a eficiência do envio e a gestão do ciclo de vida regulatório.
Principais diferenças entre a eCTD 3.2.2 e a eCTD 4.0:
- Melhor gestão do ciclo de vida: Melhoria do controlo das versões dos documentos, reduzindo a duplicação.
- Granularidade mais flexível: Permite a reutilização de documentos estruturados em diferentes submissões.
- Metadata aprimorada Metadata : metadata mais estruturados, tornando as interações regulatórias mais fluidas.
- Maior interoperabilidade: Concebido para funcionar melhor com os sistemas regulamentares digitais em evolução a nível mundial.
- Embora estas alterações ofereçam inúmeros benefícios, a transição para a eCTD 4.0 exige preparação, investimento e uma compreensão das expectativas regulamentares.
Posição EMAsobre a adoção do eCTD 4.0
A grande questão na mente de todos é: EMA o eCTD 4.0? A resposta é ainda não, mas a transição está em andamento.
Situação atual da eCTD 4.0 na UE:
- Atualmente, a eCTD 3.2.2 continua a ser a norma obrigatória para as apresentações na UE.
- EMA avaliado ativamente o eCTD 4.0, mas ainda não tornou sua utilização obrigatória.
- A agência está a trabalhar em conjunto com outros órgãos reguladores, como a FDA PMDA do Japão, para alinhar os padrões globais.
- Não foram definidos prazos oficiais para a transição, mas EMA que o eCTD 4.0 acabará por se tornar obrigatório.
Abordagem EMA: implementação faseada com um programa piloto
Ao contrário da USFDA, que delineou um plano de implementação faseado, EMA adotar uma abordagem estruturada. A agência lançou um Programa Piloto Técnico para testar a implementação do eCTD 4.0 com as partes interessadas do setor.
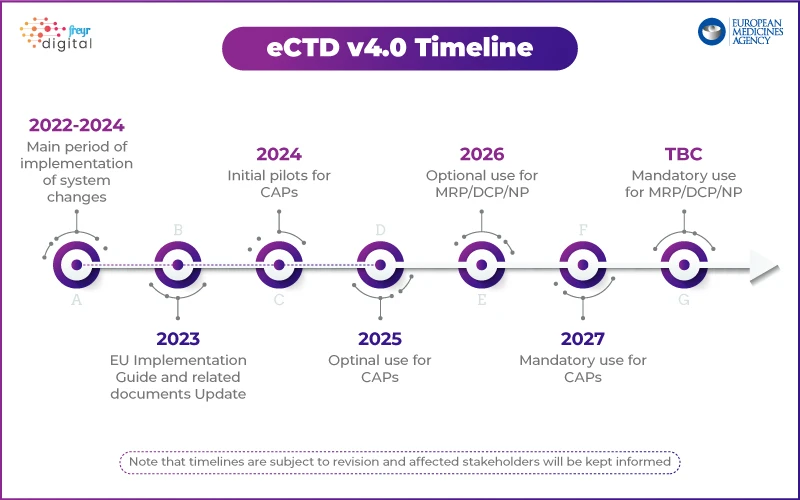
Principais destaques da estratégia eCTD 4.0 EMA:
- Etapa 1: Concentrar-se na interoperabilidade técnica com as ferramentas regulamentares.
- Fases futuras: Submissões simuladas, gestão do ciclo de vida e submissões agrupadas.
- Projeto de pacote de implementação disponível com vocabulários controlados e critérios de validação.
EMA empenhada em garantir uma transição suave, e as empresas do setor das ciências da vida devem acompanhar as atualizações na página oficial EMA .
Desafios e considerações para as empresas do sector das ciências da vida
Embora o eCTD 4.0 ofereça benefícios claros, a sua adoção não está isenta de desafios. Eis algumas considerações fundamentais para as empresas farmacêuticas e biotecnológicas:
- Complexidades regulamentares
- A transição gradual EMA significa que as empresas devem estar preparadas para processos de submissão duplos (eCTD 3.2.2 e eCTD 4.0).
- As diferentes regiões terão diferentes calendários de adoção, o que exige que as empresas se mantenham ágeis.
- Desafios técnicos
- A migração de dados da eCTD 3.2.2 para a 4.0 requer um planeamento cuidadoso.
- As regras de validação vão mudar significativamente, exigindo software e ferramentas actualizados.
- As empresas precisam de investir na automatização e em soluções baseadas em IA para garantir a conformidade.
- Riscos de conformidade
- metadata incorreto metadata ou o não cumprimento dos novos requisitos de granularidade de documentos pode levar à rejeição da submissão.
- As equipas de regulamentação necessitam de formação adequada para compreenderem as novas regras de validação.
- Impacto nos fluxos de trabalho existentes
- As empresas terão de adaptar os processos internos para acomodar a eCTD 4.0.
- Será necessária uma maior colaboração entre as equipas de regulamentação, TI e apresentação.
A principal conclusão? As empresas precisam começar a se preparar agora, mesmo que EMA ainda não EMA tornado obrigatório o eCTD 4.0.
Como as empresas podem se preparar para a transição para o eCTD 4.0 EMA
Embora EMA definido um prazo oficial, as empresas proativas beneficiarão de uma preparação antecipada. Veja como:
- Avaliar os actuais processos de apresentação
- Identificar lacunas nos actuais fluxos de trabalho da eCTD 3.2.2.
- Avaliar de que forma as novas regras de gestão do ciclo de vida afectarão as apresentações em curso.
- Investir nas ferramentas eCTD 4.0 certas
- Selecione um software de submissão regulamentar que seja compatível com o eCTD 4.0.
- Certifique-se de que o software suporta as normas HL7 RPS e metadata .
- Formar as equipas de regulamentação e de TI
- Realizar workshops e sessões de formação sobre as alterações da eCTD 4.0.
- Forneça diretrizes para metadata e o acompanhamento do ciclo de vida.
- Interaja com EMA colegas do setor
- Participe dos programas-piloto e consultas regulatórias EMA.
- Mantenha-se atualizado sobre as últimas orientações e atualizações regulatórias EMA.
- Realização de testes e validação
- Efetuar submissões de testes internos utilizando estruturas eCTD 4.0.
- Identifique potenciais problemas na granularidade dos documentos e metadata antes do mandato final EMA.
Se começarem agora, as empresas podem assegurar uma transição suave sem perturbações nos registos regulamentares.
O que é que se segue? Futuro do eCTD 4.0 na Europa
Embora o cronograma completo da transição ainda não esteja claro, a estratégia de longo prazo EMA envolve:
- Normalização das apresentações nos mercados globais, melhorando a consistência e a eficiência.
- Reduzir os prazos de aprovação através de um melhor controlo do ciclo de vida das apresentações.
- Integrar a IA e a automatização nos fluxos de trabalho regulamentares para melhorar a conformidade.
Nos próximos anos, podemos esperar mais clareza da EMA, incluindo cronogramas oficiais de transição e novos critérios de validação.
Conclusão
Embora EMA ainda não EMA obrigatório o eCTD 4.0, é apenas uma questão de tempo até que ele se torne o padrão para submissões regulatórias na UE. As empresas que se prepararem proativamente ganharão uma vantagem competitiva, garantindo a conformidade e evitando obstáculos regulatórios de última hora.
Principais conclusões
- A eCTD 3.2.2 continua a ser a norma atual, mas a eCTD 4.0 está no horizonte.
- EMA adotar uma abordagem gradual, sem qualquer mandato oficial até ao momento.
- As empresas devem começar a preparar-se desde já para garantir uma transição harmoniosa.
- O investimento em novas tecnologias, a formação de equipas e o teste de submissões serão fundamentais.
Apelo à ação
Mantenha-se atualizado com os anúncios regulamentares EMAe comece a avaliar a sua preparação para o eCTD 4.0. Quanto mais cedo se preparar, mais fácil será a transição quando a obrigatoriedade entrar em vigor.
Gostaria de ajuda para escolher um software compatível com o eCTD 4.0 ou para entender como essa transição afeta o seu negócio? reach us.









