
Para melhorar a acessibilidade de medicamentos inovadores para pacientes no Reino Unido após o Brexit, um novo e acelerado processo de aprovação, conhecido como Innovative Licensing and Access Pathway (ILAP), foi lançado em janeiro de 2021. O seu principal objetivo era fornecer um roteiro integrado para todas as partes interessadas que aprimorasse o processo de desenvolvimento de produtos. O ILAP apoia ainda mais os desenvolvedores comerciais e não comerciais, facilitando o acesso da população de pacientes a medicamentos inovadores, reduzindo o tempo de comercialização. As empresas farmacêuticas podem explorar o ILAP como uma rota, uma vez que os dados não clínicos sejam consolidados. Ele é aplicável a novas entidades químicas (NCE), medicamentos biológicos, novas indicações e medicamentos reaproveitados.
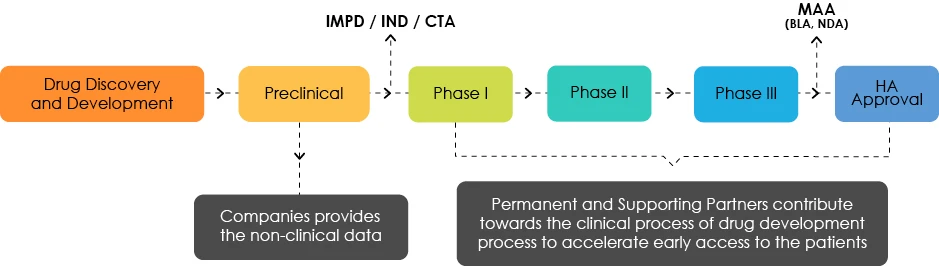
O ILAP é uma iniciativa desenvolvida em conjunto pela Agência Reguladora de Medicamentos e Produtos de Saúde (MHRA) em associação com o Centro Terapêutico e Toxicológico de Gales (AWTTC), o Instituto Nacional de Excelência em Saúde e Cuidados (NICE) e o Consórcio Escocês de Medicamentos (SMC) como parceiros permanentes. Os parceiros de apoio do ILAP incluem o Serviço Nacional de Saúde da Inglaterra (NHS), a Autoridade de Investigação em Saúde (HRA) e o Instituto Nacional de Investigação em Saúde (NIHR). Juntos, os intervenientes contribuem com informações regulamentares, científicas, éticas e comerciais aprimoradas na fase inicial do desenvolvimento de medicamentos durante os ensaios clínicos.
Na opinião de Freyr, o ILAP oferece grandes oportunidades para desenvolvedores de tratamentos inovadores, especialmente para aqueles que atendem às necessidades não atendidas dos pacientes. Por uma taxa relativamente modesta (aproximadamente £ 8.000), uma empresa pode obter aconselhamento na fase inicial, obter uma designação para o seu produto e chegar a um acordo sobre um perfil de desenvolvimento alvo. Isso tem o potencial de economizar uma quantidade significativa de tempo no ciclo de vida geral do desenvolvimento do produto. Também há vantagens em olhar além Autorização de Introdução no Mercado fazer preparativos antecipados para as negociações sobre reembolso.
O ILAP compara-se favoravelmente com esquemas semelhantes oferecidos dentro da rede europeia de medicamentos (como o PRIME). Embora diferente em conceito e entrega, o ILAP tem critérios de aceitação mais amplos e uma taxa de aceitação mais elevada. O ILAP também fornece um caminho para integração com o Projeto Orbis da Administração de Alimentos e Medicamentos dos Estados Unidos (USFDA) para produtos oncológicos emergentes.
Como candidatar-se ao ILAP?
Para aceder ao ILAP, os candidatos devem solicitar um Passaporte de Inovação (IP). A obtenção de uma designação IP permite que os desenvolvedores de medicamentos acessem o caminho com base nas evidências necessárias para que um produto cumpra os critérios de elegibilidade definidos pelo NICE, SMC, AWTTC e MHRA.
Esta designação actua como um catalisador para produtos inovadores desde a fase pré-clínica até à fase intermédia de desenvolvimento. A PI pode levar à definição de um documento de Perfil de Desenvolvimento Alvo (TDP). O TDP é um roteiro que facilita o acesso aos parceiros do ILAP nas fases iniciais do ciclo de vida do desenvolvimento do medicamento, a fim de acelerar e agilizar o acesso dos doentes a tratamentos novos e inovadores. Os doentes fazem parte de todo este processo. Várias ferramentas fornecidas pelo ILAP apoiam os candidatos em todas as fases do processo de conceção, desenvolvimento e aprovação.
Critérios de designação de passaportes inovadores
MHRA esclarece os critérios para a designação de PI. Isso é particularmente relevante para produtos inovadores e também se compara favoravelmente com esquemas equivalentes oferecidos na Europa.
No futuro, a aplicabilidade específica da PI aos dispositivos médicos e aos produtos combinados, domínios em que existe sempre uma inovação significativa, pode revelar-se benéfica.
A designação de PI é avaliada pelos parceiros permanentes e de apoio com base nos seguintes critérios
- Critério 1: Pormenores sobre a doença, o doente ou a área de saúde pública
- Para situações graves e de risco de vida
- Num evento em que a necessidade é crucial para os doentes
- Critério 2: O medicamento preenche um ou mais domínios específicos que incluem
- Medicina inovadora
- Medicamento associado a uma nova indicação
- Medicamentos para doenças raras
- Medicamento em desenvolvimento para o objetivo de saúde pública do Reino Unido
- Critério 3: O medicamento tem o potencial de oferecer
- Uma breve descrição do modo como o medicamento ou a indicação proposta irá beneficiar os doentes.
- São encorajadas as opiniões dos doentes ou das organizações de doentes.
Após o envio do submissão IP, MHRA realizada uma reunião entre os requerentes e a MHRA para verificar se o produto cumpre os três (03) critérios.
De acordo com as informações mais recentes de janeiro de 2022, a MHRA setenta e uma (71) solicitações, das quais quarenta e uma (41) resultaram na designação de PI, vinte e duas (22) estão a ser processadas e sete (07) foram recusadas.
O momento certo para entrar no ILAP é mencionado a seguir.
- Na fase inicial ou intermédia de desenvolvimento do produto
- Quando estão disponíveis dados relevantes
- Quando os candidatos sentem a necessidade de obter contributos das partes interessadas
- Os candidatos aspiram a adotar novas abordagens inovadoras
- Não quando o produto está no final da fase de desenvolvimento
Visão geral do desenvolvimento de medicamentos
Compreender o perfil de desenvolvimento alvo (TDP)
Os peritos do TDP analisam as caraterísticas do produto e destacam as deficiências do ponto de vista regulamentar. São responsáveis por orientar os criadores de medicamentos para um roteiro que permita o acesso precoce dos doentes aos seus produtos.
O TDP é um documento que é atualizado em tempo real de acordo com os requisitos alinhados com o desenvolvimento do produto. Por conseguinte, um produto é sujeito a várias alterações do TDP à medida que são gerados novos dados.
O acesso dos pacientes a medicamentos essenciais pode ser comprometido por atrasos no mercado. Para evitar tais cenários, os caminhos acelerados funcionam como um catalisador. O ILAP é um exemplo de um caminho de autorização flexível que é bem aceito em toda a indústria e pode acelerar o cronograma de desenvolvimento de medicamentos inovadores. Os critérios detalhados definidos pelo Sistema de Saúde do Reino Unido permitem que os candidatos explorem a sua elegibilidade para solicitar a designação de PI. Incentivar as necessidades clínicas e dos pacientes não atendidas com vias aceleradas como o ILAP facilita a entrada no mercado e pode proporcionar alívio às populações de pacientes em risco. Para salvaguardar os interesses dos pacientes, as autoridades sanitárias não comprometem a segurança, a eficácia ou a qualidade do produto, garantindo ao mesmo tempo um processo de aprovação acelerado.Os serviços regulamentares end-to-end da Freyr facilitam o processo de documentação para apoiar a designação do Passaporte Inovador num prazo acelerado, ajudando os seus produtos a reach mais cedo reach . Contacte a Freyr.









