
O mundo da regulamentação farmacêutica está prestes a receber uma grande atualização com a implementação do eCTD 4.0. Este formato normalizado promete uma viagem mais suave para os pedidos de novos medicamentos apresentados às entidades reguladoras. Mas para as empresas que pretendem conquistar uma fatia do mercado farmacêutico japonês de 141,5 mil milhões de dólares, há uma reviravolta crucial - o Japão está a acelerar o prazo de adoção!
Segue-se uma análise destes destaques:
- Adoção obrigatória: Ao contrário do que acontece noutras áreas que têm fases voluntárias antes da adoção obrigatória, até 2026 o Japão pretende tornar obrigatória a utilização da eCTD 4.0.
- A preparação é fundamental: A preparação é fundamental devido às restrições de tempo e à ausência de um caminho de migração direto PMDA JP1.0 PMDA do Japão para o eCTD 4.0. Concentrar-se num sistema melhor ajudará as empresas farmacêuticas no Japão durante o processo de transição. Essas etapas incluem atualizar o software, treinar a equipa e preparar PDFs para o novo formato.
- Recursos disponíveis: A Agência de Produtos Farmacêuticos e Dispositivos Médicos (PMDA) do Japão publicou recursos que podem orientar as empresas durante essa mudança, como o “Guia de Implementação do Documento Técnico ComumICH eCTD 4.0ICH ”, com explicações sobre as alterações feitas e as melhores práticas disponíveis.
Eis algumas razões pelas quais não deve perder este jogo de números:
- Caminho rápido para o eCTD 4.0: Ao contrário de outras regiões, onde o processo é faseado, o Japão tem como meta a adoção obrigatória do eCTD 4.0 já em 2026. Isso é três anos antes do prazo estabelecido pelaFDA US FDA 2029! Com um cronograma tão agressivo, isso significa que o Japão assumiu a liderança em termos de incorporação global do eCTD.
- Não há margem para erros: Ao contrário das versões anteriores, a JP não pode ser convertida diretamente para a eCTD 4.0. Isto significa que as empresas farmacêuticas têm de estar mais preparadas para este facto, de modo a evitar quaisquer atrasos na apresentação, o que lhes pode custar milhões em receitas.
- Uma ajuda para uma aterragem suave: A Agência de Produtos Farmacêuticos e Dispositivos Médicos (PMDA) do Japão compreende os desafios. Ela criou recursos como guias de implementação projetados para orientar as empresas nessas modificações com facilidade e aterrissar bem no mercado japonês. (pmda).
Se está a desenvolver medicamentos para o enorme mercado japonês, está na altura de apertar o cinto! Aqui está a sua lista de verificação pré-voo:
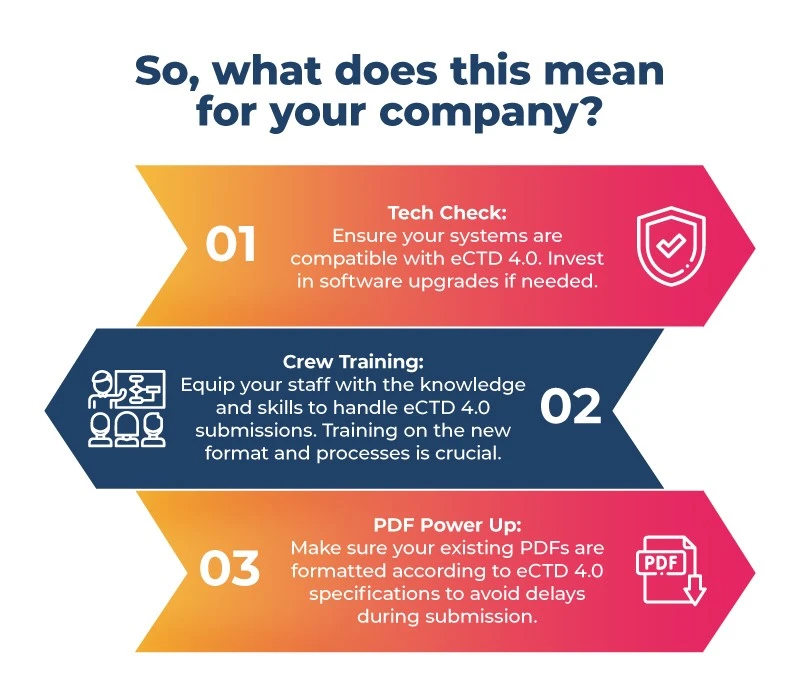
A transição para o eCTD 4.0 promete maior eficiência e padronização global em todo o processo de aprovação de medicamentos farmacêuticos. A sua empresa pode antecipar essa mudança no Japão para uma transição suave e participar das inúmeras oportunidades oferecidas por essa nova era. Lembre-se de que não se preparar é preparar-se para falhar — portanto, esteja pronto para decolar com o eCTD 4.0 no Japão.
Os benefícios e oportunidades adquiridos são atraentes para a indústria farmacêutica. No entanto, existem dificuldades ao longo do caminho que devem ser resolvidas. Para navegar sem problemas num ambiente regulatório em constante mudança, as empresas podem buscar parcerias com consultores confiáveis, como Freyr. Abrace o futuro das submissões regulatórias no Japão com o nosso software eCTD incomparável, Freyr SUBMIT PRO, que está em conformidade com 21 CFR Part 11 e possui um modelo de implementação flexível. Entre em contacto us para saber mais e embarcar numa jornada rumo a maior eficiência e sucesso. Solicite uma demonstração hoje mesmo.









