
CUMPRIMENTO DO PRAZO IDMP ATÉ JULHO DE 2016: NÃO É UMA TAREFA FÁCIL
Existem muitas perguntas sobre IDMP : onde estão localizados os dados numa organização? É necessário limpar e alinhar os dados atuais? Como as empresas organizam esses dados para facilitar a recuperação e o envio? A organização possui processos que podem se beneficiar de um repositório central?
Alcançar a conformidade com a Identificação de Medicamentos IDMP) não é uma tarefa trivial, pois a atividade deve levar em consideração várias pressões regulatórias e operacionais. As organizações devem aguardar até que as autoridades emitam orientações finais e aprovem as especificações. Ao mesmo tempo, aguardar essas orientações pode não lhes dar tempo suficiente para colocar os seus assuntos em ordem.
IDMP uma norma complexa com implicações abrangentes em termos de dados, que exige colaboração e co entre muitas unidades multifuncionais. A transição oferece uma oportunidade para uma end-to-end dos processos de negócios e das capacidades de TI de uma organização em muitas unidades funcionais. Também ajuda a estabelecer um sistema robusto de gestão de mudanças.
As organizações devem compreender que uma boa arquitetura de informação requer esforço e tempo para ser concretizada e também devem reconhecer que IDMP não IDMP apenas um XEVMPD maior. É igualmente importante notar que ICH são apenas uma parte da história e que a disponibilidade de orientações regionais é fundamental. É preciso também ter em conta que as implementações regionais paralelas terão âmbitos e prazos diferentes, com uma vasta gama de contribuintes de dados.
Além disso, as empresas farmacêuticas que pretendem comercializar os seus produtos em regiões regulamentadas devem estar IDMP a partir de 2016. Recentemente, EMA um dia IDMP IDMP e partilhou o seu estado de implementação IDMP nível e os seus prazos. Após discussão com a indústria farmacêutica, fornecedores de software e análise de seu próprio sistema e disponibilidade de recursos, EMA dividir aIDMP geralIDMP em várias iterações. Este plano será proposto à European Commission CE) para aprovação e, se eles conseguirem convencer a CE, IDMP na UE será distribuída entre 2016 e 2018. Na pior das hipóteses, se a CE não concordar, não há plano B. As multas por incumprimento podem chegar a 5% da receita de uma organização; não ter uma boa solução para IDMP inicial e contínuo IDMP é um risco que nenhuma empresa farmacêutica pode correr.
IDMP: DESENVOLVIDO COMO UM CONJUNTO GLOBAL DE NORMAS SOB A ISO
No caso de qualquer legislação que deva ser introduzida sobre a identificação de Medicamentos qualquer um dos países ISO, isso será feito com base IDMP ISO IDMP . Quando diferentes regiões adotarem as IDMP , a introdução de dados será consistente e, por sua vez, as empresas globais e os reguladores terão acesso a dados cruzados para verificar a consistência entre as regiões. Além disso, vocabulários controlados comuns facilitarão muito esse processo.
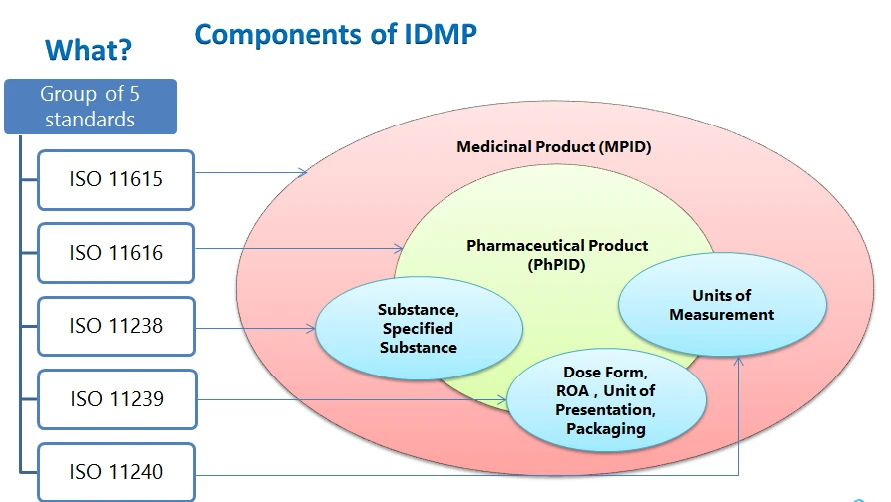
Os elementos estruturais do IDMP a identificação do medicamento, a identificação do produto farmacêutico, a identificação da substância, vocabulários controlados - forma farmacêutica, via de administração, componentes da embalagem, unidades de apresentação, unidades de medida e a descrição do processo de fabrico a ser apresentado.
IDMP
- ISO 11615 - Informações sobre medicamentos
- ISO 11616 - Informações sobre produtos farmacêuticos
- ISO 11238 - Substâncias
- ISO 11239 - Formas de dosagem farmacêutica, Unidades de apresentação, Vias de administração e Embalagem
- ISO 11240 - Unidades de medida
ESTADO ACTUAL
ICH preparar guias de implementação e a rever as normas ISO.
REGULADORES DA UE PREPARAM-SE PARA IDMP
- EMA um trabalho de articulação com a rede regulatória da UE para definir os casos de negócios para os IDMP .
- EMA a criar um «IDMP ISO IDMP da UE” recrutar especialistas dos EMA e do Conselho de Dados da Rede da UE para alcançar este objetivo. Mais especificamente, irá:
- Definir elementos IDMP ISO IDMP obrigatórios e opcionais
- Definir regras de negócio para elementos de dados opcionais
- Definir a conformidade e os tipos de dados
- Definir os modelos de governação da UE
POSIÇÃO US
- Liderança ativa no IDMP com os reguladores globais (antiga ICH) e com a ISO
OUTRAS ENTIDADES REGULADORAS
- Suíça - Tenciona implementar depois da UE (seguidor rápido)
- O Japão e o Canadá nomearam reguladores para serem peritos no grupo de IG da Substância
HORÁRIOS
GUIAS EUROPEUS DE APLICAÇÃO
- Projeto de guias de aplicação iniciado e os guias estarão disponíveis a partir do primeiro trimestre de 2016
OUTROS
- FDA ainda FDA uma data, mas pretende desenvolver o SPL conforme necessário.
- Japão – Incerto na ICH agora a trabalhar no grupo regulador e na ISO
- Canadá - Prevê-se que seja implementado, mas ainda não há pormenores
- Suíça - Ainda não há actualizações
COMPREENDER OS REQUISITOS IDMP
IDMP informações sobre Medicamentos termos de um conjunto de identificadores padrão, que são construídos com base numa hierarquia de identificação criada durante a construção do Dicionário de Medicamentos EudraVigilance (EVMPD) ou na sua forma alargada (xEVMPD). Haverá uma sobreposição de informações com as arquivadas no Structured Product Labeling (SPL) nos US noutros registos de produtos a nível global.
No entanto, IDMP novos identificadores, novas categorias e novas formas de expressar as relações entre os elementos no modelo de dados. IDMP ser integrado ao DNA da organização, pois precisa impulsionar a construção de modelos de dados em toda a empresa. A infraestrutura de TI de uma organização pode então reconhecê-lo em vários sistemas, processos de negócios e unidades funcionais, como RA, Segurança, P&D, documentação e processos de fabricação.
DESAFIOS IDMP
Organizacional
- Dados distribuídos por vários departamentos
- É necessário um patrocínio sénior para incentivar a participação
Técnica
- Descobrir, recolher e consolidar dados limpos
- 250 a 300 campos por produto
Co
- Gestão da mudança contínua
- Co entre várias equipas
- Manter a regulamentação dos dados com processos internos
EM CONCLUSÃO:
IDMP: IMPACTO NA INDÚSTRIA FARMACÊUTICA
Espera-se que a implementação das IDMP tenha impacto na preparação e planeamento de submissões e na manutenção de dados em toda a empresa, incluindo dados de fabrico e informações estruturadas sobre substâncias para informações de registo.
IDMP : GANHOS DE EFICIÊNCIA GARANTIDOS APÓS A IMPLEMENTAÇÃO
Garantir que a sua organização esteja pronta para enfrentar o IDMP exigirá uma estreita cooperação entre vários departamentos dentro da sua organização. Um prestador de serviços competente, com um portfólio exclusivo de competências regulatórias, pode ajudar na transição para IDMP , o que pode ajudar uma organização a responder às novas oportunidades em evolução no mercado.









