
A necessidade de medicamentos que salvam vidas está em constante aumento. Devido ao surgimento de novas doenças fatais, os fabricantes de medicamentos estão a investir muito tempo e dinheiro na investigação e desenvolvimento de medicamentos químicos e biológicos. Por mais desafiante que seja inventar medicamentos inovadores, pode ser igualmente assustador para os fabricantes registá-los. Desde a preparação e apresentação do submissão Investigação de Novo Medicamento submissão IND) até aos Pedidos de Ensaios Clínicos (CTAs) e Autorizações de Comercialização (MAs), há uma série de procedimentos regulamentares a seguir, conforme prescrito pelas respetivas Autoridades de Saúde (HAs).
Os fabricantes devem acertar à primeira, para que os medicamentos inovadores reach mercado sem atrasos. Isso ajudará a atender à demanda por medicamentos que salvam vidas em mercados específicos e garantirá o retorno sobre o investimento (ROI) para os fabricantes.
A necessidade de soluções regulamentares melhoradas e de processos conformes é, por conseguinte, bastante crucial. Existem várias razões pelas quais os fabricantes não conseguem seguir o caminho adequado.
Desafios regulamentares enfrentados pelos fabricantes de medicamentos inovadores
- Falta de compreensão das complexidades regulamentares
- Conhecimento limitado das várias fases de apresentação de propostas às agências de seguros
- Prazos para a apresentação dos dossiers médicos, do Documento Técnico Comum (DTC), dos Relatórios de Estudos Clínicos (RCE), etc.
- Diferenças na regulamentação quando os medicamentos são vendidos a nível mundial
- Falta de preparação para lidar com quaisquer problemas ou dificuldades que surjam na fase de fabrico
Vantagens de colaborar com o fornecedor correto de serviços/soluções de regulamentação:
O parceiro certo assegurará que todas as etapas de fabrico de medicamentos estão em conformidade com os organismos reguladores relevantes e conduzirão a apresentações atempadas.
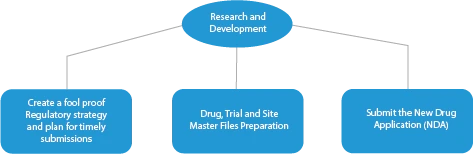
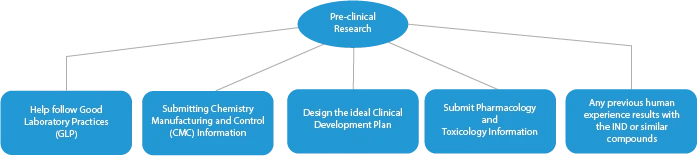
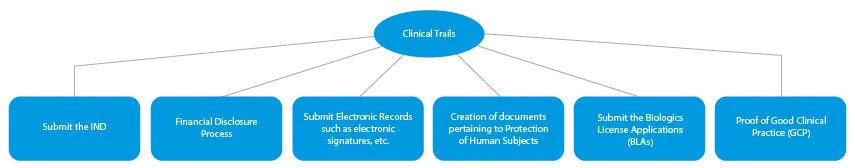
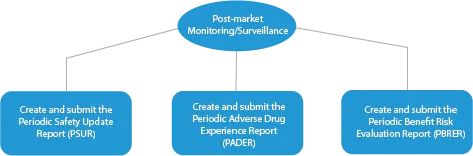
Existem quatro (04) fases de fabrico de medicamentos inovadores. São as seguintes:
- Investigação e desenvolvimento
- Investigação pré-clínica/ensaios
- Ensaios clínicos
- Monitorização/vigilância pós-comercialização
Todas as fases do desenvolvimento de um medicamento requerem uma série de documentos que têm de ser apresentados às HAs. Aqui está uma descrição de como um fornecedor de serviços regulamentares estabelecido ajudará em todas as fases.
Palavra final
Com o aumento da esperança de vida da população global, há uma necessidade de descobrir novos medicamentos. A inovação no campo das ciências da vida levou a várias invenções em medicamentos que salvam vidas. Muitos deles estão em várias fases de fabrico. Seja qual for a fase em que o seu produto se encontra, colaborar com um prestador de serviços regulatórios global como Freyr, que tem experiência no registo de medicamentos inovadores, pode ajudá-lo a evitar a não conformidade e garantir que os novos medicamentos reach mercado a tempo. Mantenha-se informado. Mantenha-se em conformidade.









