
No mundo em evolução dos dispositivos médicos, a conformidade não é uma tarefa única - é um compromisso contínuo. A monitorização contínua e as actualizações dos principais relatórios, como os Relatórios de Avaliação Clínica (CER), os Relatórios de Avaliação de Desempenho (PER) e os Relatórios Periódicos de Atualização de Segurança (PSUR), são essenciais ao longo de todo o ciclo de vida de um dispositivo médico, desde a investigação inicial até à vigilância pós-comercialização. À medida que o panorama dos avanços médicos e os requisitos regulamentares evoluem continuamente, garantir a segurança e a conformidade dos dispositivos médicos e dos IVDs através de uma redação médica eficaz continua a ser a pedra angular do sucesso e da viabilidade a longo prazo.
Vejamos como a gestão do ciclo de vida continua a ser essencial para o sucesso de um dispositivo médico
O lançamento de um dispositivo médico é o culminar de anos de esforço despendido em várias fases, como a investigação, o desenvolvimento, os ensaios clínicos, as apresentações regulamentares e a vigilância pós-comercialização. Este processo estende-se por muitos anos e cada fase acumula dados vitais em grande quantidade, que têm de ser cuidadosamente compilados e analisados para garantir que o dispositivo continua a ser seguro.
A conformidade não é uma questão pontual, e uma gestão eficaz do ciclo de vida ajuda a evitar atrasos que podem ser dispendiosos mais tarde. Estes atrasos ocorrem frequentemente devido a um planeamento ineficaz para alterações regulamentares imprevistas ou não conformidade, que podem ter sido negligenciadas. As actualizações regulares de documentos críticos como os CER, PER e PSUR garantem que os fabricantes cumprem os requisitos regulamentares em evolução e mantêm a segurança dos produtos. A gestão do ciclo de vida garante que os fabricantes, desde o início, planearam cada fase e, assim, podem evitar quaisquer armadilhas e garantir uma entrada bem sucedida no mercado e a longevidade dos seus dispositivos.
Está a acompanhar a conformidade?
Das ligaduras aos implantes, a indústria dos dispositivos médicos é um sector de ponta, criativo e com muitas perspectivas. Apesar do forte desejo dos fabricantes de fornecer ao mercado produtos seguros e de elevada qualidade, existe, no entanto, ambiguidade. O EU MDR substituiu a Diretiva relativa aos dispositivos médicos (MDD) e a Diretiva relativa aos dispositivos médicos implantáveis activos (AIMDD). Este regulamento foi implementado para impor controlos mais rigorosos, melhorar a segurança dos doentes e promover uma maior transparência no sector dos cuidados de saúde. Existe muita incerteza sobre estas normas e as questões cruciais de conformidade são frequentemente ignoradas. No entanto, os fabricantes de dispositivos médicos devem tomar medidas para evitar dificuldades regulamentares.
Vamos investigar os desafios mais comuns enfrentados pelos fabricantes de dispositivos médicos
- Manutenção de CAPA (Corrective and Preventive Action)
- Cumprimento dos procedimentos de reclamação
- Seguir os procedimentos de vigilância
- Avaliação Clínica e Vigilância Pós-Comercialização
- Ligação aos organismos notificados
Melhores práticas para manter a conformidade
Para ultrapassar estes desafios, Freyr criou
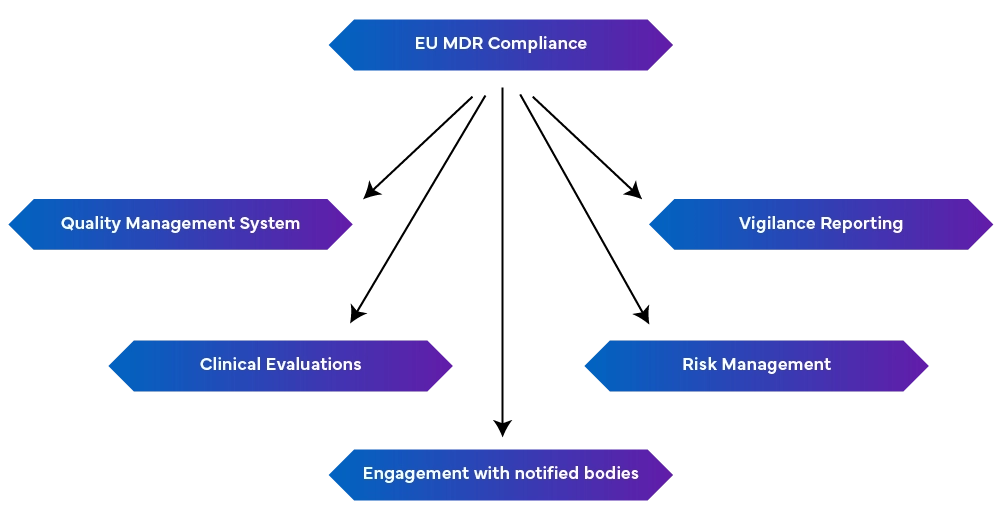
-Umsistema de gestão da qualidade robusto (EN ISO 13485:2016): Inclui aspetos de produção, incluindo conformidade regulamentar, documentação técnica, declarações de conformidade da UE e gestão de riscos.
-Relatórios de vigilância: Manter a comunicação da vigilância como um processo contínuo e não como um esforço pontual.
- Gestão proactiva dos riscos: Identifica e atenua os riscos ao longo do ciclo de vida do dispositivo, actualizando-o regularmente para fazer face aos riscos emergentes.
- Realizar avaliações clínicas e vigilância pós-comercialização: Isto é feito através da demonstração da segurança e do desempenho do dispositivo utilizando dados clínicos. Se necessário, devem ser realizadas investigações clínicas e as avaliações clínicas devem ser regularmente actualizadas com dados de vigilância pós-comercialização. Também são necessários relatórios periódicos de atualização de segurança que resumam os resultados.
- Ligação com os Organismos Notificados: As alterações nos regulamentos podem afetar os requisitos do MDR, tornando crucial manter uma boa relação com os Organismos Notificados para actualizações e modificações rápidas.
Como é que um especialista em regulamentação o pode ajudar
Tentar manter-se a par de um panorama regulamentar em constante mudança pode ser difícil. Por isso, porque não deixar que um especialista o guie através deste labirinto? Gerir as exigências regulamentares do ciclo de vida de um dispositivo médico não é apenas complexo, mas também exige muitos recursos. No caso de empresas mais pequenas, em que os recursos internos podem ser melhor utilizados noutras áreas, a ajuda de um parceiro regulamentar externo pode revelar-se indispensável. Estes oferecem conhecimentos especializados sobre a evolução dos regulamentos e asseguram que os seus principais relatórios - tais como CERs, PERs e PSURs - são continuamente actualizados e estão em conformidade.
Pode evitar atrasos dispendiosos, prevenir a não conformidade e simplificar o seu processo de aprovação. Além disso, um especialista em regulamentação pode oferecer soluções personalizadas com base nas necessidades específicas do seu dispositivo, garantindo que a vigilância pós-comercialização, a análise de lacunas e toda a documentação de conformidade estão actualizadas. O seu envolvimento pode tornar o processo geral mais simples, minimizar os riscos e garantir que o dispositivo pode cumprir as expectativas de segurança e desempenho.
Freyr pode ajudá-lo com todas as suas necessidades regulamentares relativas à gestão do ciclo de vida. Reach us hoje mesmo!









