
A indústria farmacêutica da China registou um crescimento substancial desde a sua entrada na Organização Mundial do Comércio (OMC). Em 2021, a China detém uma quota de 12% do mercado farmacêutico mundial, o que a torna o segundo maior contribuinte. De acordo com a agência noticiosa Xinhua, o mercado farmacêutico chinês gerou 708,75 mil milhões de yuan em 2021, enquanto as empresas chinesas de medicamentos nacionais acumularam 502 mil milhões de USD em lucros.
Como deve saber, a Administração Nacional de Produtos Médicos (NMPA), a autoridade sanitária da China, começou a aceitar pedidos Autorização de Introdução no Mercado MA) e pedidos de ensaios clínicos (CTAs) em formato eCTD, abrindo caminho para mais oportunidades. No entanto, isso traz consigo um conjunto de desafios.
Neste blogue, analisamos o mundo das apresentações de Documentos Técnicos Comuns Electrónicos (eCTD), uma vez que se estão a tornar rapidamente no método de referência para a apresentação de documentos na indústria farmacêutica.
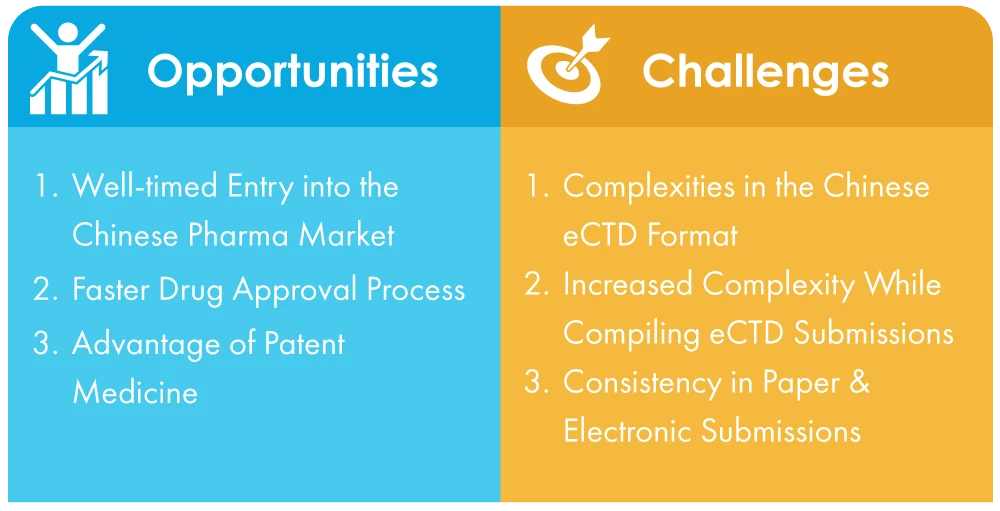
Desafios enfrentados pelas empresas na China para se adaptarem às apresentações obrigatórias de eCTD
- Complexidades do formato eCTD chinês: Ao contrário da norma universal, que é bastante simples, o formato eCTD chinês é complicado e pode ser difícil de ultrapassar para as empresas que não estão familiarizadas com o processo. Este facto pode levar a contratempos na apresentação das credenciais essenciais.
- Maior complexidade na compilação de submissões eCTD: NMPA, autoridade sanitária da China, implementou novas regras e regulamentos para apoiar a transição para submissões eletrónicas, mas as empresas ainda precisam lidar com um ambiente complexo e dinâmico. Isso pode ser mais desafiador para as empresas que não têm presença local ou conhecimento profundo do ecossistema regulatório da China.
- Apoio multilingue na apresentação de documentos em papel e electrónicos: Os documentos têm de ser apresentados em mandarim com versões em inglês como referência, o que pode ser uma tarefa difícil para as empresas que não têm afiliações com tradutores linguísticos qualificados.
Oportunidades durante a transição de apresentações em papel para apresentações sem papel
- Entrada oportuna no mercado farmacêutico chinês: A entrada no mercado chinês tornou-se mais conveniente graças às reformas transformadoras e às actualizações das políticas implementadas. Uma das principais alterações é a adoção de submissões electrónicas, que simplifica o processo e elimina muitos dos desafios que as empresas enfrentavam anteriormente. Este é um testemunho do empenhamento da China em promover ajustamentos estruturais, transformações processuais e o crescimento global do mercado.
- Processo de aprovação de medicamentos mais rápido: Agora que as apresentações se tornaram electrónicas, o processo de aprovação de medicamentos será muito mais rápido e, por conseguinte, o processo de introdução de medicamentos no mercado será mais suave e mais rápido. Isto acabará por ajudar as grandes empresas farmacêuticas a aumentar ainda mais a quota da China no mercado farmacêutico mundial.
- Vantagens dos medicamentos patenteados: Os medicamentos patenteados são o segundo maior segmento de produtos com grandes margens de lucro. No entanto, o fabrico de medicamentos originais implica longos períodos de retorno, custos elevados de I&D e períodos de I&D prolongados. Com a implementação de submissões electrónicas, todos estes obstáculos podem ser resolvidos. A partir de 2022, as empresas estrangeiras continuam a ser os principais participantes neste mercado. Assim, é um nicho de mercado para este segmento.
Como estar preparado para esta nova implementação na China?
A transição para o envio obrigatório de eCTD na China apresenta uma série de oportunidades para as empresas que desejam permanecer competitivas no maior mercado farmacêutico do mundo. Ao estabelecer parcerias com os especialistas certos, as empresas podem navegar pelo cenário regulatório em constante evolução com facilidade e confiança. Para se manter à frente da concorrência, é fundamental ter uma subsidiária com presença local e conhecimento das regulamentações da HA. Freyr SUBMIT PRO, um software de publicação e envio, ajuda os fabricantes a entrar no mercado farmacêutico chinês com facilidade. Para saber mais sobre a ferramenta, solicite uma demonstração.









