Enquanto os medicamentos inovadores ou de marca implicam custos adicionais associados à investigação e desenvolvimento do produto, desde a fase de identificação da molécula até à autorização pós-comercialização, os medicamentos genéricos são relativamente económicos. Estas terapias não só reduzem o custo global do tratamento, como também melhoram significativamente o acesso dos doentes a medicamentos que salvam vidas. Uma vez que a dependência da importação de antibióticos genéricos e da terapia com medicamentos para doenças raras afectou a disponibilidade destes medicamentos a nível mundial durante a pandemia, as agências de saúde estão a introduzir novas orientações para apoiar os fabricantes locais de medicamentos.
Desde 1993, a organização comercial Medicines for Europe, anteriormente conhecida como Associação Europeia de Medicamentos Genéricos (EGA), tem sido consistente com o seu objetivo de familiarizar a população europeia com terapias eficazes em termos de custos. Ao longo da última década, forneceram com sucesso 67% de todos os medicamentos para a Europa, ampliando o acesso dos doentes para 100% em sete (07) áreas terapêuticas chave. No âmbito da competência das autoridades de saúde europeias, uma "autonomia estratégica" pós-Brexit pôs em marcha um requisito imediato para remediar eficazmente a desvantagem competitiva enfrentada pelos fabricantes europeus de genéricos e biossimilares. Com o advento da pandemia de COVID-19, as capacidades da cadeia de abastecimento mundial sucumbiram à pressão da procura de medicamentos. Os medicamentos que salvavam vidas e que proporcionavam alívio de doenças crónicas desapareceram das prateleiras das farmácias locais. Para ultrapassar os obstáculos que se colocam aos medicamentos protegidos por patentes e criar capacidades locais de fabrico de medicamentos para melhorar o acesso dos doentes, o Conselho da UE adoptou um regulamento que prevê uma exceção a uma molécula original através de um Certificado Complementar de Proteção (CCP). A disposição facilita o fabrico de genéricos e biossimilares antes da expiração da patente para efeitos de armazenagem ou exportação. No entanto, a exceção só será aplicável nas seguintes circunstâncias.
- Os genéricos ou biossimilares produzidos destinam-se exclusivamente à exportação para outro país onde a patente da molécula do medicamento não exista ou tenha expirado, ou para fins de armazenamento dentro do prazo de validade da patente de seis (06) meses.
- De acordo com o requisito, o fabricante transmitiu a informação à autoridade sanitária local e ao titular do RCP antes de três (03) meses.
- O fabricante informou todas as partes interessadas na comercialização do produto.
- O fabricante assegurou-se de que os requisitos de rotulagem indicam que o medicamento se destina exclusivamente à exportação.
De facto
Desde a concessão da Autorização de Introdução no Mercado condicional Autorização de Introdução no Mercado produtos vacinais Autorização de Introdução no Mercado a COVID-19 na UE, o Comité dos Medicamentos para Uso Humano (CHMP) da Agência Europeia de Medicamentos autorizou quatro (04) locais para a produção de vacinas num ano; dois (02) na Suíça e dois (02) nos EUA. Tais decisões a favor da expansão dos locais de produção irão aumentar a capacidade de fabrico de vacinas, tornando-as mais acessíveis à população europeia.
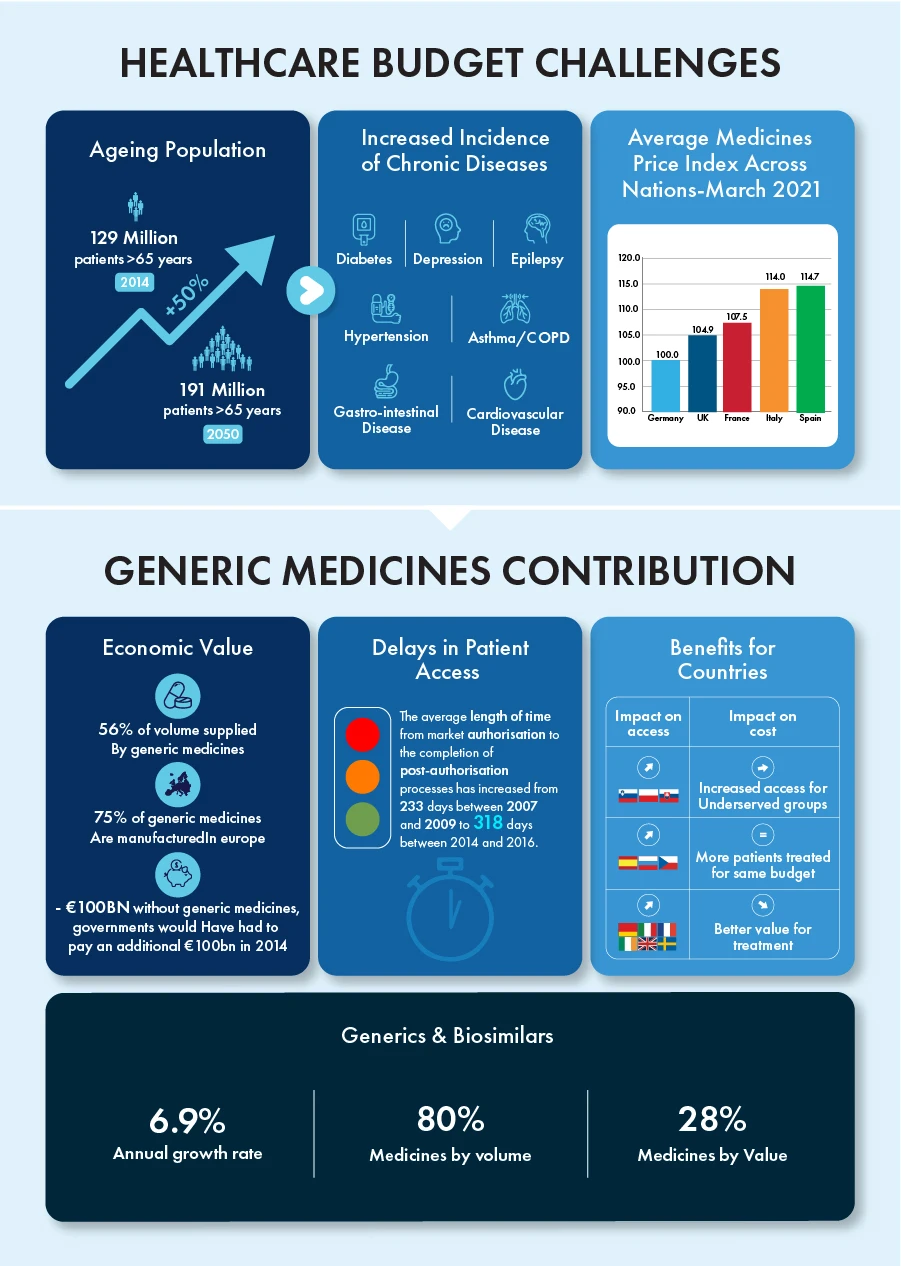
Os genéricos e os biossimilares contribuíram sozinhos para uma taxa de crescimento anual de 6,9%, representando 80% de todos os medicamentos em volume e 28% em valor na última década. O prazo de validade das patentes de certos produtos biológicos avaliados em cerca de 90 mil milhões de euros terminará em 2023, criando um ambiente competitivo para estes produtos com um enorme potencial de crescimento.
A aplicação de uma isenção do RCP beneficiaria a União Europeia ao
- O que representa um acréscimo de cerca de 90,5 mil milhões de euros por ano.
- Gerar vinte e cinco mil (25 000) novas oportunidades de emprego, com dois mil (2000) empregos diretos para a indústria de API da UE. A iniciativa ajudará member states da UE member states 3,1 mil milhões de euros em despesas com cuidados de saúde.
- Armazenamento de alternativas mais baratas de medicamentos patenteados inovadores para permitir a sua entrada no mercado imediatamente após a expiração da propriedade intelectual (PI), melhorando o acesso dos doentes.
Para um fabricante de medicamentos sediado fora da União Europeia, a implementação da isenção de SPC é uma das iniciativas mais gratificantes a favor dos genéricos. Uma vez que a Autoridade de Saúde da UE regula os medicamentos para uso humano e veterinário através de um procedimento centralizado ou descentralizado, navegar pelos requisitos locais específicos pode tornar-se uma tarefa exaustiva. Um especialista, ciente dos requisitos locais relativos a vários pedidos e documentos de licença, pode ajudá-lo a concentrar os seus esforços em protocolos de produção essenciais, em vez de se fixar em obstáculos regulamentares complexos. Reimagine o potencial do seu negócio ao experimentar a conformidade e a qualidade. Contacte Freyr.









