
A ideia de submissões regulatórias eletrónicas para produtos farmacêuticos é anterior à própria ferramenta eCTD. No final da década de 1980, iniciativas como a CANDA (Computer-Aided New Drug submissão, ou submissão de Novos Medicamentos Assistida por Computador) foram exploradas pelaFDA Food and Drug Administration, ou Administração de Alimentos e Medicamentos) US e por agências europeias. Esses primeiros esforços buscavam aumentar a eficiência e o acesso aos dados para os revisores.
Introduzir a norma eCTD (2003):
A Conferência Internacional sobre Harmonização (ICH) surgiu em 2003 com uma grande inovação: o padrão eCTD (documento técnico comum eletrónico). Esse formato padronizado foi projetado para estabelecer uma linguagem universal para envios eletrónicos em todo o mundo.
O surgimento de ferramentas eCTD:
Com a adoção da norma eCTD, aumentou a procura de ferramentas eCTD especializadas. Estas ferramentas trouxeram várias vantagens importantes:
- Criação de conteúdos simplificada: Os utilizadores podem criar e organizar documentos sem esforço, de acordo com a estrutura eCTD.
- Validação robusta: as ferramentas eCTD garantiram que os envios cumpriam as especificações técnicas, evitando atrasos causados por erros de formatação.
- Gestão eficiente do ciclo de vida: A gestão de revisões, o controlo de versões e a manutenção da conformidade regulamentar tornam-se mais fáceis.
Estas inovações revolucionaram o processo de submissão regulamentar, tornando-o mais eficiente e fiável.
Como o software Freyr automatiza a criação de eCTD
A solução de software avançada Freyr , Freyr PRO, aborda esses desafios automatizando aspectos essenciais da criação do eCTD, aumentando assim a eficiência e reduzindo o erro humano.
Otimização de recursos: Ao automatizar tarefas repetitivas, o nosso software liberta recursos humanos valiosos. Os profissionais podem concentrar-se em actividades mais estratégicas e de maior valor, como a análise de dados, o desenvolvimento de estratégias regulamentares e o envolvimento das partes interessadas. Esta mudança não só aumenta a produtividade como também reduz os custos operacionais, proporcionando um retorno significativo do investimento.
Minimização do risco de erro humano: A automatização minimiza o risco de erro humano, garantindo que os dados são transferidos com precisão e que os documentos são formatados corretamente. As verificações de validação incorporadas no software e os mecanismos de deteção de erros melhoram ainda mais a qualidade e a conformidade das submissões regulamentares. Isto reduz a necessidade de retrabalho e ajuda a garantir aprovações atempadas.
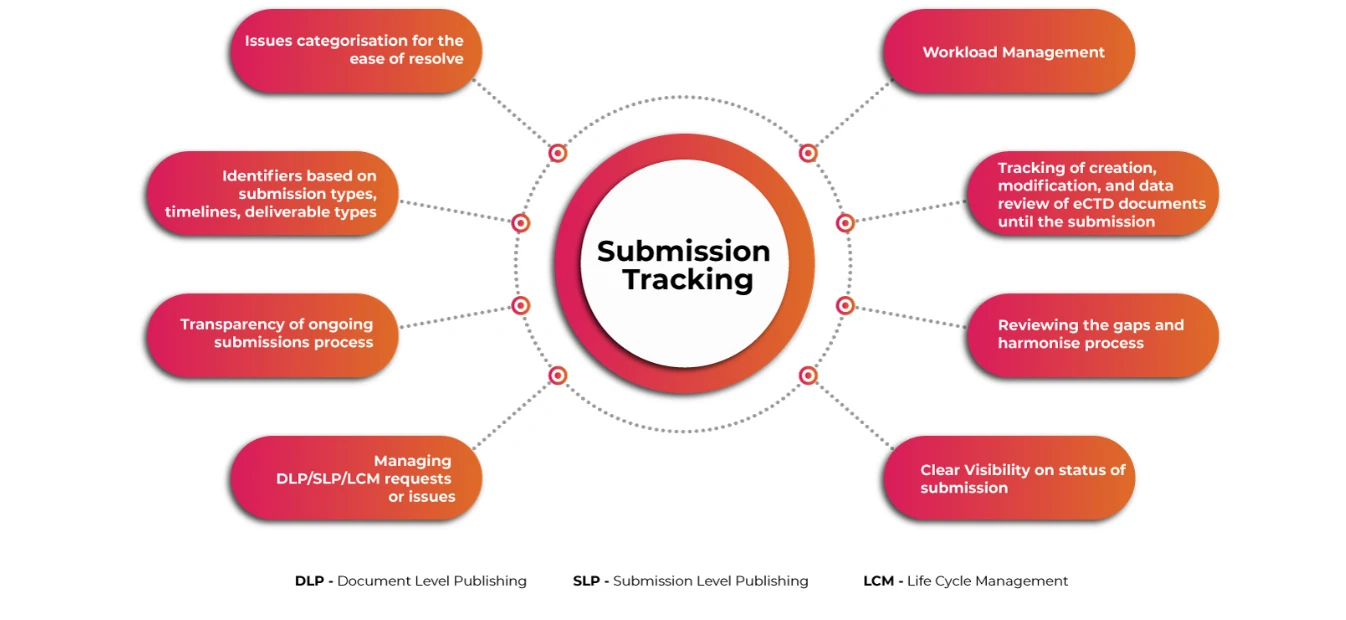
Rastreador de envios para uma perspetiva abrangente dos envios de eCTD
Um sistema automatizado de fácil utilização para o planeamento e acompanhamento de actividades complexas de apresentação de eCTD globais, gestão do fluxo de trabalho de actividades e armazenamento e gestão de pedidos regulamentares e informações de apresentação é essencial para garantir que os requerentes enfrentam os desafios associados muito antes do tempo. A visibilidade das operações de apresentação e publicação a um nível granular torna todo o processo de apresentação mais simples e rápido.
Acompanhamento da apresentação
A última atualização do eCTD
A mudança para o eCTD 4.0 anuncia maior eficiência e padronização global no processo de aprovação de medicamentos farmacêuticos. Ao preparar-se para essa transição, a sua empresa poderá navegar sem problemas pela mudança e capitalizar as inúmeras oportunidades que essa nova era . Embora a mudança para o eCTD 4.0 possa apresentar desafios, eles são superáveis com dedicação e determinação de todos os países envolvidos. Embora sejam necessários investimentos e esforços significativos, os benefícios substanciais do eCTD 4.0 fazem com que o empreendimento valha realmente a pena.
Revisão do processo de apresentação: A eCTD 4.0 promete revolucionar a forma como as empresas farmacêuticas apresentam os dados de desenvolvimento de medicamentos às autoridades de saúde. O seu objetivo é simplificar o processo de apresentação.
Cronograma de implementação: A FDA aceitar novos pedidos no formato eCTD 4.0 a partir de 2024. As fases futuras abordarão os pedidos existentes na versão 3.2.2 e a comunicação bidirecional.
Compatibilidade futura: A eCTD 4.0 inclui compatibilidade futura, permitindo o ciclo de vida e a reutilização de documentos do conteúdo da v3.2.2. Isto simplifica a conversão de aplicações v3.2.2 para a eCTD 4.0.
Critérios de validação: Estão disponíveis especificações para os critérios de validação da eCTD 4.0. Estes critérios garantem a qualidade e a exatidão das apresentações.
Conformidade global: Até 2026, os organismos reguladores de todo o mundo poderão exigir a conformidade com as normas eCTD 4.0. Embora atualmente seja voluntária, a aplicação começará entre 2026 e 2029.
O futuro do eCTD:
É necessário acolher a IA e tornar a sua função regulatória dinâmica, pois ela agrega valor ao seu negócio. Freya Fusion é uma plataforma de gestão de informações regulatórias (RIM) de ponta, impulsionada por IA e nativa da nuvem, que oferece desempenho, segurança e escalabilidade excepcionais, mantendo a conformidade rigorosa com as normas GxP. Aprimorada com recursos avançadosML automação, Freya Fusion no mundo digital, oferecendo funcionalidade superior e uma experiência de usuário excepcional. Os avanços em IA da Freyr prometem módulos de produção e acompanhamento de submissões, abrangendo funcionalidades para compilação, publicação e validação contínuas de submissões regulamentares, garantindo a conformidade meticulosa com as diretrizes eCTD. Manter-se à frente no jogo da conformidade regulamentar com SaaS alimentado por IA certamente beneficiará a sua empresa. Seja com um sistema de alerta precoce para mudanças regulamentares, revisão e análise simplificadas de documentos regulamentares ou análises preditivas para gestão de riscos, Freyr tem tudo o que precisa. Reach comhello@freyrdigital.compara descobrir as nossas inovaçõesML que simplificam as operações regulamentares na indústria médica.
Mantenha-se à frente da concorrência com atualizações regulares e avanços tecnológicos. Faça uma parceria us otimizar as suas operações regulatórias, aumentar a produtividade e elevar a qualidade das submissões. Solicite uma demonstração hoje mesmo e experimente a combinação perfeita de conhecimento e ferramentas. Impulsione a sua organização de boa para excelente. Entre em contacto us hoje mesmo.









