
As Autorizações de Utilização de Emergência (EUAs) são importantes para Medicamentos mais rapidamente Medicamentos que salvam vidas aos pacientes. Elas têm sido úteis no combate a pandemias como a COVID-19. Uma iniciativa da Food and Drug Administration (USFDA) dos Estados Unidos teve início no ano de 2004, e a EUA entrou em vigor quando a Seção 564 da Lei Federal sobre Alimentos, Medicamentos e Cosméticos foi alterada pela Lei Project BioShield. Este programa é uma medida tomada pela FDA proteger a saúde pública, garantindo a segurança, a eficácia e a qualidade dos produtos médicos, ao mesmo tempo que lida com emergências médicas e ameaças emergentes à saúde pública.
us melhor nas linhas a seguir.
Descodificar a EUA
A via EUA é um meio para facilitar o acesso a contramedidas médicas em situações de emergência declaradas. O Comissário da FDA autorizar o seguinte nessas situações:
- A utilização autorizada de produtos médicos não aprovados.
- A utilização não autorizada de produtos médicos aprovados.
Os produtos abrangidos pela EUA incluem vacinas, fluidos intravenosos, medicamentos, dispositivos, testes, etc., e podem ser utilizados para diagnosticar, tratar ou prevenir doenças potencialmente fatais. Os produtos recebem a EUA se os seguintes critérios forem cumpridos:
- Prova de uma doença/patologia potencialmente mortal.
- Os dados científicos fornecem provas suficientes de que o produto é eficaz para a utilização a que se destina.
- Os benefícios do produto superam os riscos (também conhecidos como provas de segurança).
- Falta de produtos alternativos.
Recomenda-se que os patrocinadores compreendam antecipadamente os requisitos FDA, para que possam seguir o melhor processo regulatório e garantir uma submissão de EUA sem erros. A seguir estão as informações obrigatórias que precisam ser compartilhadas pelo patrocinador na submissão.
Dados a serem apresentados pelo patrocinador à FDA aprovação da EUA
- Descrição do produto e sua utilização prevista.
- O estado de aprovação do produto junto à FDA
- Informações sobre segurança e eficácia, tais como dados clínicos e não clínicos, etc.
- Relatório de análise risco-benefício.
- Dados de Química, Fabricação e Controles (CMC).
- Informações sobre a dosagem, as contra-indicações, as advertências e os acontecimentos adversos para a distribuição do produto médico em questão.
Como são emitidas as EUA pela FDA?
Segue-se uma breve interpretação esquemática do ciclo de vida das EUA:
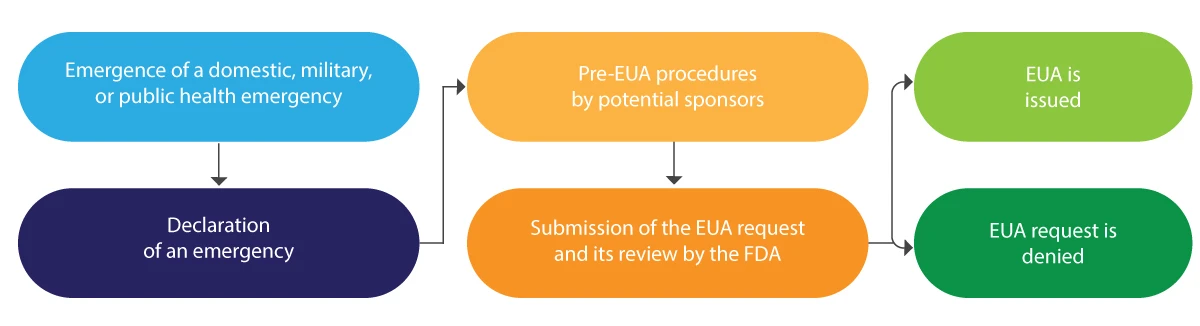
A EUA é normalmente emitida por um período limitado e, no final da referida emergência, é rescindida pela FDA.
EUA e COVID-19
O Secretário de Saúde e Ciências Humanas (HHS) declarou a COVID-19 como uma pandemia em 31 de janeiro de 2020. Desde então, a FDA sido fundamental na aprovação de algumas vacinas e kits de teste caseiros sob o protocolo EUA para lidar com o surto global em curso.
Com o surgimento de novas variantes da COVID-19, toda a indústria farmacêutica está a trabalhar arduamente para conter a propagação e reduzir as taxas de mortalidade. Há uma necessidade de novos Medicamentos aprovações mais rápidas pelas autoridades regulatórias globais, para que o tempo de comercialização seja reduzido. A via EUA para o registo de novos Medicamentos é o caminho a seguir, de acordo com especialistas. Várias outras autoridades sanitárias, como a Agência Europeia de Medicamentos (EMA), a Central Drugs Standard Control Organization CDSCO), a Saudi Food and Drug Authority SFDA), etc., também implementaram a via EUA para aprovações mais rápidas.
Se é fabricante de medicamentos e procura uma EUA para o seu produto que salva vidas, precisará de um fornecedor experiente em soluções regulatórias. Reach com Freyr um tempo de comercialização mais rápido e um caminho em conformidade.









