
As empresas farmacêuticas que procuram novas perspectivas comerciais consideram a Coreia do Sul um mercado atrativo com uma indústria farmacêutica em rápido crescimento. Com mais de novecentos (900) novos medicamentos em preparação e exportações no valor total de 3,1 mil milhões de dólares, a Coreia do Sul oferece um enorme potencial para o fabrico de grandes produtos farmacêuticos.
Na Coreia do Sul, a apresentação de um submissão novo medicamento submissão NDA) ou submissão licença biológica submissão BLA) é uma etapa crítica para a comercialização de novos produtos farmacêuticos. O Ministério da Segurança Alimentar e Farmacêutica (MFDS) é responsável pela análise e aprovação de NDAs e BLAs na Coreia do Sul. O processo de análise pode demorar até 180 dias, mas se o medicamento for designado como prioritário ou acelerado, esse prazo pode ser reduzido.
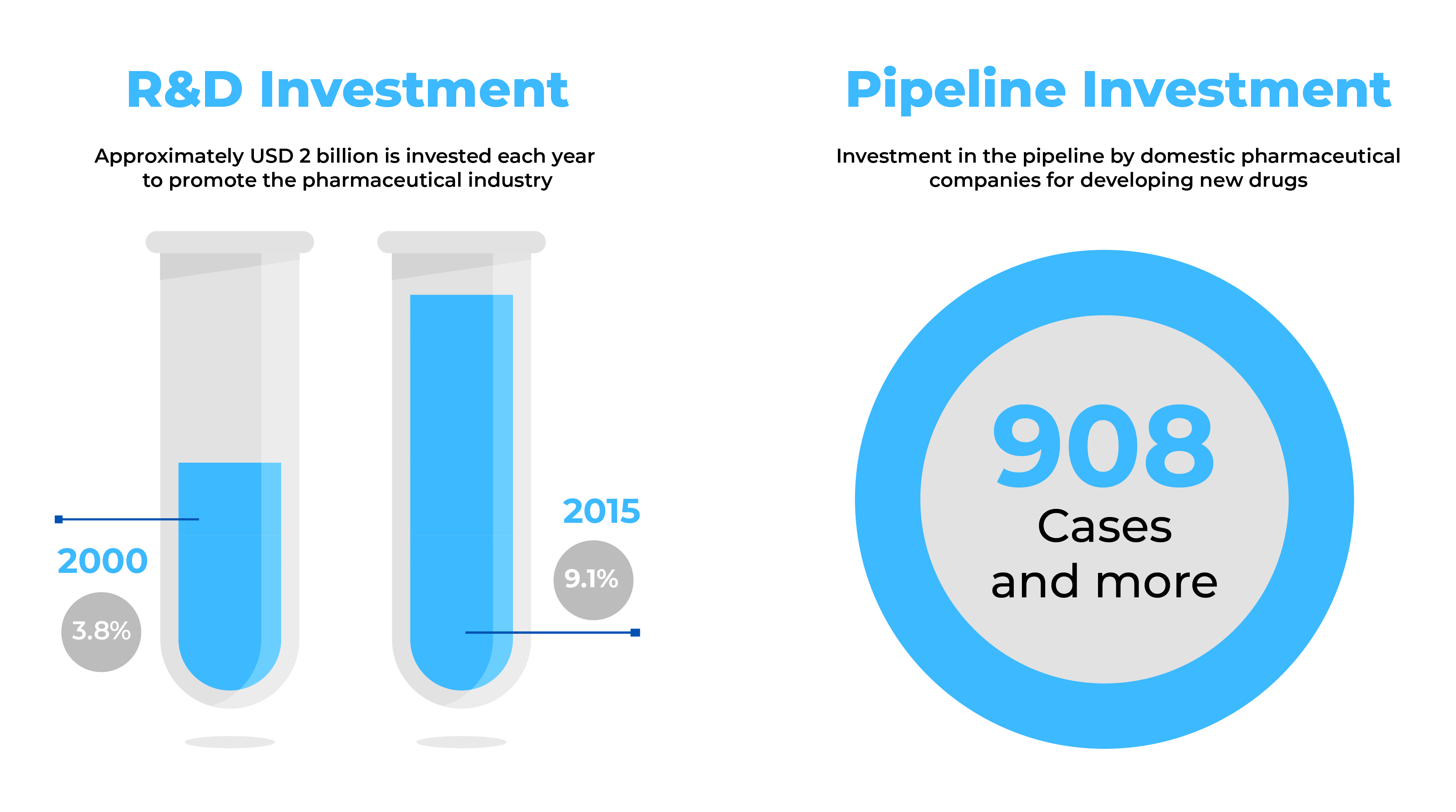
Fonte: Tendências do sector da saúde - setembro de 2014 e dados globais (2017)
BLA na Coreia do Sul oferecem vantagens como um processo de aprovação mais rápido, regulamentos e requisitos claros, incorporação de Evidências do Mundo Real (RWE) e isenções para medicamentos órfãos. No entanto, oBLA na Coreia do Sul pode ser complexo e demorado. O processo de submissão de um submissão Medicamento Novo submissão NDA) ou submissão Licença Biológica submissão BLA) na Coreia do Sul envolve várias etapas.
Eis um resumo do processo:
- Ensaios pré-clínicos: Antes de um medicamento poder ser avaliado em seres humanos, deve primeiro ser testado em animais para garantir a sua segurança e eficácia. Normalmente, estes ensaios são efectuados em animais.
- Ensaios clínicos: Após a conclusão da pesquisa pré-clínica, o medicamento avança para os ensaios clínicos em humanos. Estes estudos são divididos em três (03) fases, cada uma com um número maior de participantes.
- BLA : Após a conclusão dos estudos clínicos, o patrocinador pode submeter um NDA BLA Ministério da Segurança Alimentar e Medicamentos (MFDS) da Coreia do Sul. Todos os cinco (05) módulos do Documento Técnico Comum Eletrónico (eCTD), que abrangem dados não clínicos, clínicos e de Química, Fabricação e Controlo (CMC), devem ser incluídos na submissão.
- Aprovação: Se o MFDS determinar que o medicamento é seguro e eficaz, oBLA aprovado. O medicamento pode ser anunciado e vendido na Coreia do Sul após a aprovação.
Ainda não responde a todas as tuas perguntas?
Deixemos que os peritos nos esclareçam.
Para obter uma perspetiva detalhada sobreBLA na Coreia do Sul, Freyr um webinar gratuito com os nossos especialistas da Coreia do Sul. Junte-se us a “Visão geral doBLA na Coreia do Sul”, agendado para 29 de novembro de 2023, às 11h30 IST (ROW) e às 10h00 EST | 15h00 GMT | 16h00 CET (Américas e EUA). Inscreva-se agora! Fique seguro. Fique informado.
Para as regiões AMR e UE
10: 00 AM EST | 3:00 PM GMT | 4:00 PM CET
Para RoW
11:30 AM IST









