
No dinâmico mundo dos produtos farmacêuticos, o papel dos dados do mundo real (RWD) e das evidências do mundo real (RWE) está a tornar-se cada vez mais importante. Estas ferramentas fazem a ponte entre o ambiente controlado dos ensaios clínicos e as complexidades do mundo real dos cuidados aos pacientes. Várias empresas farmacêuticas têm utilizado com sucesso os RWD/RWE para apoiar os seus pedidos de regulamentação. Por exemplo, em 2022, a Bristol Myers Squibb recebeu FDA para o uso do Opdivo (nivolumab) em combinação com o Yervoy (ipilimumab) para o tratamento de melanoma metastático de primeira linha com base nos dados RWE do ensaio CheckMate 151.
Com o recente FDA orientação FDA em outubro de 2023 abrindo caminho, é hora dos inovadores farmacêuticos aproveitarem o potencial dos RWD e RWE para submissões regulatórias.
O RWD/RWE pode ser utilizado para apoiar uma variedade de submissões regulamentares, incluindo:
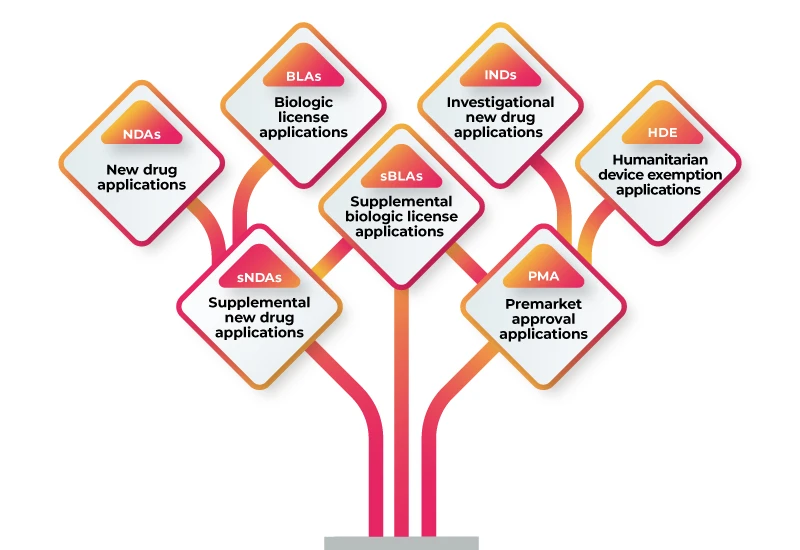
Para utilizar o RWD/RWE para apoiar a sua apresentação regulamentar, deve seguir estes passos:
Passo 1: Definir a questão regulamentar
Comece o seu percurso identificando a principal questão regulamentar que pretende abordar. Quer se trate de segurança, eficácia ou desempenho em cenários do mundo real, a clareza do seu objetivo é fundamental.
Passo 2: Selecionar fontes de RWD de qualidade
A qualidade é a chave aqui. Escolha fontes de RWD que estejam diretamente relacionadas com a sua questão regulamentar. Os registos de saúde electrónicos, os dados de reclamações médicas e os registos de doentes são recursos valiosos.
Etapa 3: Elaborar uma conceção de estudo sólida
O desenho do seu estudo deve refletir a sua questão regulatória e seguir as diretrizes regulatórias. A sua abordagem deve estar alinhada com as expectativas FDA.
Etapa 4: Analisar e gerar RWE
Utilize métodos estatísticos sólidos para a sua análise. Uma documentação clara é essencial para garantir a transparência e a credibilidade.
Etapa 5: Interpretar e apresentar as suas conclusões
A objetividade é a pedra angular da interpretação da RWE. A sua apresentação deve ser adaptada ao seu público, transmitindo a totalidade das provas com precisão.
Seguem-se algumas sugestões para utilizar RWD/RWE para apoiar a sua apresentação regulamentar:
- Complementar, não substituir os ensaios clínicos: O RWD/RWE melhora as provas de segurança e eficácia, mas não substitui os ensaios clínicos bem concebidos.
- Limitações transparentes: Reconhecer a natureza observacional do RWD/RWE, potenciais enviesamentos e factores de confusão não controlados.
- Colaborar com as agências reguladoras: Trabalhe em estreita colaboração com as agências reguladoras para alinhar a sua utilização de RWD/RWE com as suas expectativas.
Ao seguir estes passos e sugestões, pode utilizar o RWD/RWE para apoiar a sua apresentação regulamentar e colocar o seu produto no mercado de forma mais rápida e eficiente.
Ao embarcar nesta viagem de RWD e RWE, lembre-se de que está a preparar o caminho para submissões regulamentares mais eficientes e informadas. O futuro da inovação farmacêutica reside nas provas do mundo real. Abrace-a, aproveite-a e deixe a sua marca na indústria.
Pronto para otimizar o seu processo de submissão regulamentar? Explore o nosso software de submissão regulamentar de última geração Freyr PRO hoje mesmo!









