
Após quase duas (02) décadas da emissão da primeira versão preliminar da orientação, a Food and Drug Administration (FDAUS finalizou a orientação sobre farmacocinética populacional (PK) em fevereiro de 2022. A versão preliminar mais recente explica a submissão PK populacional no desenvolvimento de medicamentos e recomendações sobre individualização terapêutica. A orientação aplica-se aos pedidos de Investigação de Novos Medicamentos (IND), Pedidos de Novos Medicamentos (NDAs), Pedidos de Licença Biológica (BLAs) e Pedidos Abreviados de Novos Medicamentos (ANDAs).
Os dados da análise PK da população devem ser incluídos pelos promotores/fabricantes de medicamentos nos pedidos de comercialização para simplificar as actividades pós-comercialização. Podem também ser cruciais para responder a questões regulamentares das Autoridades de Saúde (AS).
Compreender a PK da população
O estudo da variabilidade das concentrações dos medicamentos numa população de doentes que recebem doses clinicamente relevantes de um medicamento específico é definido como PK populacional. O seu objetivo é identificar e quantificar as fontes de variabilidade que são úteis no fabrico e na recomendação de doses dos referidos medicamentos.
A ilustração seguinte pode ser utilizada para compreender todo o processo de PK da população:
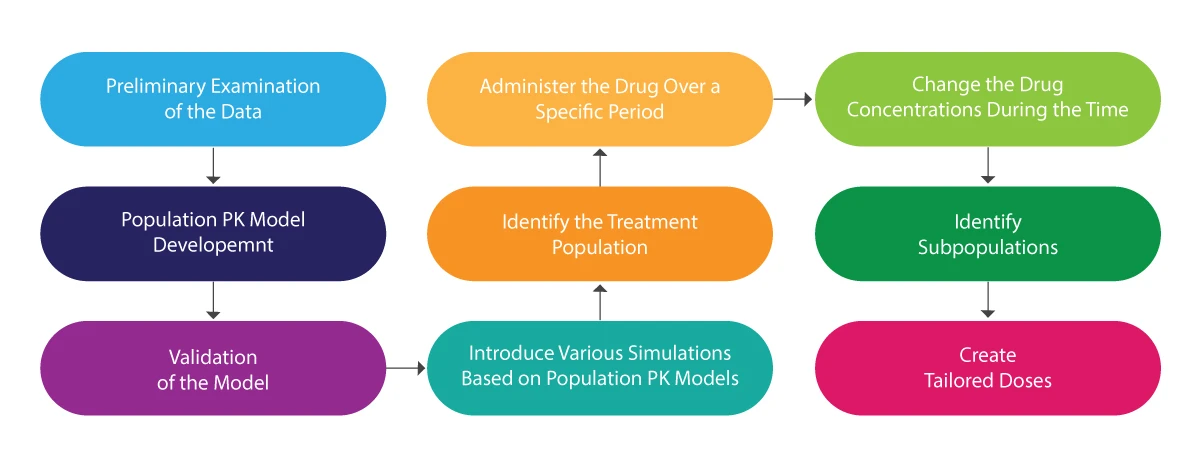
Análise PK da população - Como é que ajuda?
- Ajuda na conceção de regimes de dosagem personalizados.
- Fornece uma estimativa fiável da covariável (uma variável cuja alteração pode ser prevista numa investigação/estudo e pode ser utilizada para prever o resultado do referido estudo).
- Tem em conta factores como a demografia, o ambiente, a biologia, os medicamentos concomitantes (outros medicamentos que os doentes estão a tomar durante o ensaio) e a concentração do medicamento.
- Útil na conceção de ensaios clínicos mais seguros e qualitativos, incluindo pediátricos.
- Obter a matriz de exposição para efetuar a análise da exposição-resposta.
Uma visão geral da orientação finalFDA US sobre farmacocinética populacional
A versão final do rascunho dá uma ideia do pensamento atual FDAsobre os dados da análise farmacocinética populacional e as submissões de modelos para ajudar a tomar decisões regulatórias. Aqui está uma breve visão geral do rascunho:
Rotulagem - Fornece recomendações sobre a incorporação da informação adequada da referida análise na rotulagem. Os resultados têm de ser apresentados na secção "Farmacologia clínica" e devem ser resumidos noutras secções da rotulagem, conforme necessário.
Conteúdo - O conteúdo e o formato relevante a ser seguido para a apresentação de relatórios farmacocinéticos populacionais à FDA também FDA detalhados.
Tomada de decisões regulamentares - Os relatórios PK da população que são úteis para a tomada de decisões regulamentares têm de ser incluídos no módulo 5 do documento técnico comum eletrónico (eCTD).
Seguir em frente
Os patrocinadores que precisam de aconselhamento sobre o uso da análise farmacocinética populacional no seu processo de desenvolvimento de medicamentos ou para responder a questões regulatórias foram solicitados a fazê-lo em suas reuniões importantes com a Agência. Além disso, é imperativo garantir um bom desempenho do modelo para obter resultados precisos. Isso pode ser alcançado usando dados farmacocinéticos suficientes sobre a população específica de pacientes e subpopulações relevantes.
Pode ser um desafio para os fabricantes/patrocinadores de medicamentos apresentar relatórios farmacocinéticos populacionais precisos no formato eCTD e seguir as regulamentações de rotulagem para conformidade. Reach com um especialista em regulamentação como Freyr, que pode ajudá-lo com as suas submissões e atividades de rotulagem regulamentar .









