
Ein medikamentöses Therapieschema besteht aus verschiedenen Medikamenten, die in Kombination mit einem bereits zugelassenen Medikament verwendet werden können, oder aus zwei gleichzeitig entwickelten neuen Medikamenten, die die Wirksamkeit synergistisch verstärken. Bei Krebstherapien mit nur einem Medikament hat sich die Arzneimittelresistenz als große Bedrohung für Patienten erwiesen, die mit Krebsmedikamenten behandelt werden. In Anbetracht der Vielfalt der Kombinationstherapien, die bei der Krebsbehandlung zum Einsatz kommen, werden die Monotherapien allmählich durch Zwei-Wirkstoff-Therapien als Standardbehandlung abgelöst. Im Laufe des Jahrzehnts hat die Kombinationstherapie eine bessere Behandlungsmöglichkeit geschaffen.
Wenn Sie zu einer Organisation gehören, die sich des Paradigmenwechsels in der Entwicklung von Krebsmedikamenten von der Entwicklung einzelner Medikamente hin zu neuartigen Kombinationen bewusst ist, wissen Sie sicherlich, dass dieser Fortschritt zu einer Zunahme von Anträgen auf Cross-Labeling-Genehmigungen durch die Antragsteller geführt hat. Aufgrund von Gesprächen, den neuesten Branchentrends und ihrem aktuellen Verständnis der Anforderungen der Sponsoren hat die US (USFDA) eine Reihe von Leitlinien herausgegeben, um Unterstützung bei Änderungen der Kennzeichnung von Arzneimittelregimen mit zuvor zugelassenen Arzneimitteln zu bieten.
Herzlichen Glückwunsch! Ihrem Ersuchen um Anleitung zur gegenseitigen Kennzeichnung wurde stattgegeben, wenn:
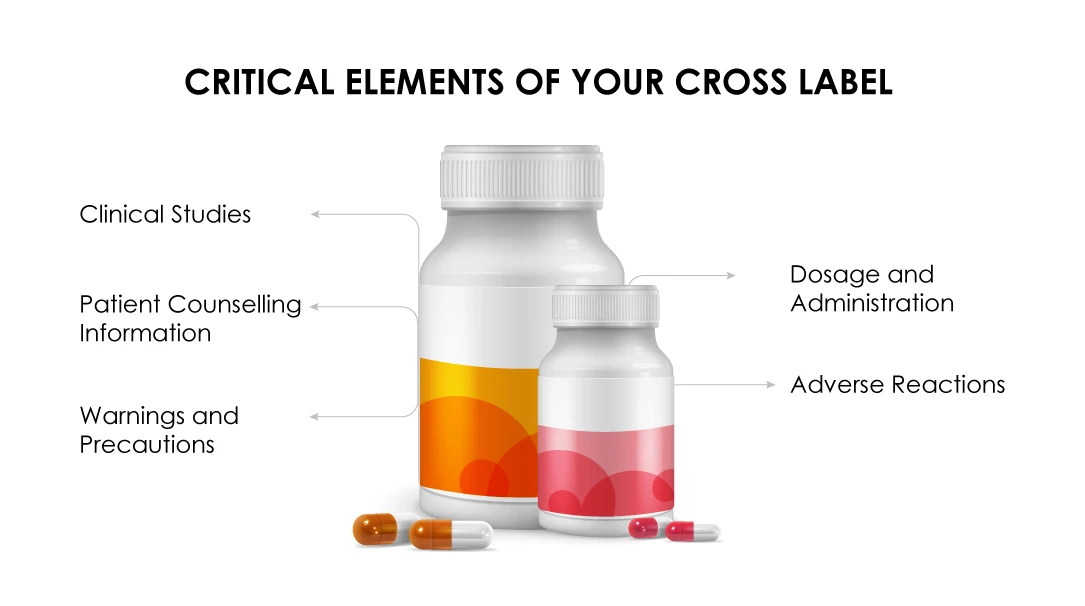
(a) Die Indikation für das beantragte Kombinationspräparat ist unter einer ähnlichen Arzneimittelindikation zugelassen .
(b) Im Abschnitt " Dosierung und Verabreichung " muss die empfohlene Dosierung für das Arzneimittel des Sponsors in einem Kombinationsschema angegeben werden.
(c) Die Daten der klinischen Studie müssen den Nutzen der Kombination für alle Arzneimittel in dem Regime rechtfertigen.
(d) Im Abschnitt "Warnhinweiseund Vorsichtsmaßnahmen " muss die Einzigartigkeit des Kombinationsschemas auf der Grundlage klinisch signifikanter Daten angegeben werden.
(e) Die in den klinischen Prüfungen beobachteten Nebenwirkungen müssen hervorgehoben werden.
(f) DiePackungsbeilage für die Patientenberatung muss sich auf die einzigartigen Toxizitäten gemäß der Formulierung beschränken.
Die übrigen Abschnitte des Etiketts müssen ausschließlich Informationen über das Arzneimittel des Sponsors enthalten, es sei denn, es müssen besondere pharmakokinetische Faktoren erwähnt werden.
Der genehmigte Leitfaden für das Cross-Labeling zielt speziell auf Krebsmedikamente ab, um das grundlegende Verständnis des Cross-Labeling zu vermitteln. Der Leitfaden soll Sponsoren bei operativen und regulatorischen Hindernissen im Zusammenhang mit Änderungen der Kennzeichnung helfen:
- Zeitleisten
Von den Antragstellern wird erwartet, dass sie in ihrem Antrag auf Cross-Labeling eines neuen Krebsmedikaments in einemNDA BLA den Entwurf für den Inhalt des Cross-Labeling mit einer evidenzbasierten Begründung für die Rolle jedes einzelnen Produkts, das im Rahmen der Therapie erwähnt wird, vorlegen.
Es wird erwartet, dass das Cross-Labeling für jedes Medikament des Regimes gleichzeitig festgestellt wird. Die Genehmigung kann jedoch aufgrund der unterschiedlichen Zeitpläne für die Arzneimittel nacheinander erteilt werden.
- Regulierungsvorlage
Jeder Antragsteller, der eine gegenseitige Kennzeichnung anstrebt, muss einen Originalantrag oder einen Wirksamkeitsnachtrag für die gegenseitige Kennzeichnung einreichen.
Ein Antragsteller kann sich auf Daten anderer Anträge berufen, um den synergistischen Nutzen der Kombinationstherapie zu begründen.
Während der Bezugnahme auf Daten, Der Antragsteller:
- muss sicherstellen, dass die querverwiesenen Daten bereits bei der FDA eingereicht wurden.
- muss jeden Abschnitt der Daten des Antragstellers, auf den verwiesen wird, mit einem Vermerk versehen.
- sollte nur Informationen enthalten, die für das Arzneimittel des Antragstellers relevant sind (siehe Abschnitt unten):
- KARTON-WARNUNG (falls zutreffend)
- DARREICHUNGSFORMEN UND STÄRKEN
- KONTRAINDIKATIONEN
- ARZNEIMITTELWECHSELWIRKUNGEN
- VERWENDUNG IN BESTIMMTEN BEVÖLKERUNGSGRUPPEN
- OVERDOSAGE
- BESCHREIBUNG
- KLINISCHE PHARMAKOLOGIE
- NICHTKLINISCHE TOXIKOLOGIE
- REFERENZEN
- WIE GELIEFERT/LAGERUNG UND HANDHABUNG
Cross-Labeling für Krebsmedikamente kann dazu beitragen, Patienten über Dosierung, Wirksamkeit und Vorteile der Behandlungsergebnisse aufzuklären. Angesichts der exponentiellen Zunahme von Kombinationstherapien als Standardmethode kann sich Cross-Labeling als vorteilhaft für die Verbesserung oder Einführung bestehender Therapiemethoden erweisen. Die erfahrenen Experten von Freyr mit den Herausforderungen des dynamischen Labelings bestens vertraut und können Ihnen Lösungen für Ihre Labeling-Fragen bieten. Erleben Sie professionelle Labeling-Unterstützung vom Feinsten. Kontakt Freyr!









