
Eine effektive Kommunikation hat schon immer die Sicherheit und Qualität der Patientenversorgung gewährleistet. Seit Jahren besteht jedoch ein ungedeckter Bedarf an Übersetzungen von Etiketten für Personen, die nicht fließend Englisch sprechen. Die Nachfrage nach Produktetiketten in mehreren regionalen Sprachen ist exponentiell gestiegen, da Pharmaunternehmen den Wandel hin zu Lokalisierung und besserer Kommunikation vorantreiben wollen.
Die Erfüllung dieser Anforderungen wird die Patientensicherheit erhöhen und gleichzeitig die Einhaltung der länderspezifischen gesetzlichen Anforderungen ermöglichen. Das Fehlen wichtiger medizinischer Informationen in regionalen Skripten stellt eine zusätzliche Belastung für Apotheker und medizinisches Fachpersonal dar, da sie die Sprachbarriere überwinden müssen.
Die Health Products Regulatory Authority (HPRA) ist für die Einhaltung der Vorschriften in Irland zuständig. Die HPRA erleichtert die Zusammenarbeit mit den Interessengruppen, indem sie sich an die von der Koordinierungsgruppe für gegenseitige Anerkennung und dezentrale Verfahren - Mensch (CMDh) herausgegebenen Leitlinien für die mehrsprachige Kennzeichnung hält. Darüber hinaus hat die HPRA auch bestimmte Bedingungen für die Kennzeichnung gelockert, darunter:
- Verwendung von mL Irland (IE) im Vergleich zu ml anderen EU-Staaten.
- Verwendung von Dezimalpunkten in der Produktmenge oder -stärke und eines Punktes in IE gegenüber einem Komma in der EU. Die Hersteller von Arzneimitteln können diese Diskrepanz überwinden, indem sie den erfundenen Namen, die Stärke und die Darreichungsform in jeder Sprache zu einer Einheit zusammenfassen.
- Verwendung eines Trennzeichens bei der Angabe der Stärke oder des Volumens des Arzneimittels - ein Punkt in der EU und ein Komma in Irland. Die Verwendung von Kommas als Trennzeichen ist auf der unmittelbaren äußeren Umhüllung erlaubt, um eine Verwechslungsgefahr für die irische Patientenpopulation zu vermeiden.
- Kleine unmittelbare Verpackungseinheiten, d. h. Behältnisse mit einer Größe von 50 ml oder weniger, haben nur begrenzten Platz und können, soweit gerechtfertigt, die erforderlichen Mindestangaben für mehr als zwei (02) Sprachen enthalten.
- Informationen über Drittländer - wenn die Bedingungen für die Produktinformationen im Vereinigten Königreich und in Irland ähnlich sind, sind Mehrländerpackungen zulässig. Zusätzliche länderspezifische Anforderungen werden in einem "blauen Kasten" aufgeführt.
- Koordinierung der Bewertung mit den anderen Member States Von den Member States durchgeführte Mock-up-Bewertungen Member States die Einhaltung der Kennzeichnungsvorschriften. Antragsteller können sich mit den Member States abstimmen, Member States Klarheit über die erforderlichen Änderungen zu erhalten, bevor sie ihre Anträge bei der HPRA einreichen.
- Gemeinsame Namen – Die Hervorhebung des erfundenen Namens als Hilfsmittel für die Member States der HPRA mitgeteilt werden.
HPRA unterbreitet folgende zusätzliche Vorschläge für die mehrsprachige Kennzeichnung:
- Informationen in englischer Sprache sind in einem Block zusammenzufassen.
- Erwähnen Sie die "Blue-Box"-Anforderungen für alle Länder auf demselben Feld, wenn sich mehrere Länder ein Paket teilen.
- Informationen, die sich an irische Patienten richten, müssen eindeutig in einem ovalen Code angegeben werden.
- Der Antragsteller kann einen perforierten Abschnitt auf der Verpackung anbringen, sofern die herausnehmbaren Daten nicht in englischer Sprache sind. Dies muss bei der Einreichung angegeben werden.
- Die Antragsteller müssen der HPRA am Ende des Verfahrens eine PDF-Datei der Packungsbeilage zur Aktualisierung auf der Website vorlegen.
Kriterien für ein mehrsprachiges Paket:
- Der Produktname und seine Stärke müssen in allen Sprachen gleich sein.
- Die Angaben auf dem Etikett und in der Packungsbeilage müssen mit der Zusammenfassung der Merkmale des Arzneimittels (SmPC) übereinstimmen.
- Die auf der Etikettierung und der Packungsbeilage aufgedruckten Informationen müssen korrekt und gut lesbar sein.
- Der rechtliche Status der Droge muss in beiden Ländern ähnlich sein.
Ein Beispiel für eine mehrsprachige Verpackung wäre:
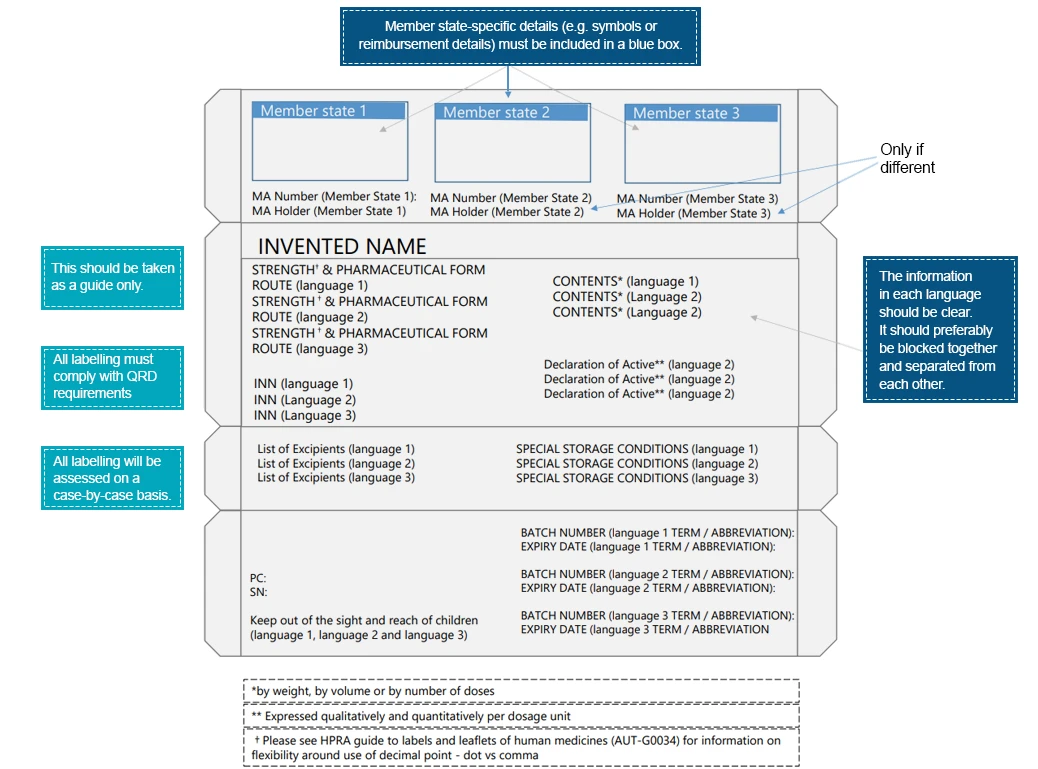
Patienten kommen mit den Arzneimitteletiketten in Kontakt, lange bevor sie mit dem Arzneimittel selbst in Berührung kommen. Diese Interaktionen unterstreichen einmal mehr, wie wichtig es ist, wesentliche Informationen über verschiedene Elemente des Arzneimitteletiketts zu vermitteln. Um eine bessere Lesbarkeit und Improvisation der Etikettenelemente zu gewährleisten, müssen Pharmaunternehmen die erforderlichen Maßnahmen ergreifen. Regionale Sprachen bieten ein Medium zur Vermittlung medizinischer Anweisungen, die für das Arzneimittel relevant sind und eine sichere und wirksame Anwendung des verschriebenen Produkts gewährleisten. Länderspezifische Regulierungsexperten können bei der Übersetzung von Etikettierungsinformationen in Übereinstimmung mit lokalen/regionalen Vorschriften behilflich sein.Die Experten Freyr sind bestens gerüstet, um Ihnen dabei zu helfen, die Lücke zwischen medizinischen Informationen und Sprache zu schließen. Reach us einen konformen Weg zur Etikettierung.









