
Die Entwicklung und Zulassung von Medikamenten für Kinder ist ein wichtiger Aspekt der pädiatrischen Gesundheitsversorgung. Aufgrund ethischer und praktischer Erwägungen sind klinische Studien mit Kindern jedoch oft nur in begrenztem Umfang möglich. Daher spielt die Kennzeichnung von Kinderarzneimitteln eine entscheidende Rolle, um die sichere und angemessene Anwendung von Medikamenten bei dieser gefährdeten Bevölkerungsgruppe zu gewährleisten. In diesem Blog werden wir die Anforderungen an die Kennzeichnung von Kinderarzneimitteln in der Europäischen Union (EU) und den Vereinigten Staaten (US) vergleichen, um ein besseres Verständnis für die Gemeinsamkeiten und Unterschiede zwischen diesen beiden (02) Regulierungsrahmen zu gewinnen.
EU-Anforderungen an die pädiatrische Kennzeichnung
Die EU hat spezifische Anforderungen an die Kennzeichnung von Arzneimitteln für Kinder. Diese Anforderungen stellen sicher, dass Arzneimittel für Kinder angemessen getestet, zugelassen und gekennzeichnet sind, um sichere und wirksame Behandlungsmöglichkeiten für pädiatrische Patienten zu bieten.
Sicherheit von Kinderarzneimitteln gewährleisten. Kontaktieren Sie Us
Pädiatrische Arzneimittelsicherheit jetzt gewährleisten
Hier sind einige Aspekte der EU-Kennzeichnungsvorschriften für Kinder:
- Pädiatrische Prüfkonzepte (PIPs): Bevor ein Arzneimittel für Kinder zugelassen werden kann, muss ein PIP bei der Europäischen Arzneimittelagentur (EMA) eingereicht werden. Darin werden die Studien und Daten beschrieben, die zur Bewertung der Sicherheit, Wirksamkeit und Dosierung des Arzneimittels bei pädiatrischen Populationen erforderlich sind.
- Zulassung für die pädiatrische Verwendung (PUMA): Wenn ein Arzneimittel bei Kindern untersucht wurde und die Anforderungen erfüllt, kann es eine PUMA erhalten. Mit dieser Zulassung kann das Medikament für die pädiatrische Verwendung vermarktet werden.
- Altersgemäße Formulierungen: Arzneimittel für die pädiatrische Verwendung sollten in altersgerechten Darreichungsformen verfügbar sein, z. B. als Flüssigkeiten, Kautabletten oder altersgerechte Dosierhilfen.
- Pädiatriespezifische Zusammenfassung der Merkmale des Arzneimittels (SmPC): Die SmPC ein Dokument, das detaillierte Informationen über ein Arzneimittel enthält. Bei pädiatrischen Produkten sollte sie spezifische Angaben zur Dosierung, Verabreichung und zu Sicherheitsaspekten für verschiedene Altersgruppen enthalten.
- Pädiatrische Warnhinweise und Vorsichtsmaßnahmen: Der Beipackzettel sollte alle spezifischen Warnhinweise oder Vorsichtsmaßnahmen im Zusammenhang mit der Anwendung des Arzneimittels bei Kindern enthalten, wie z. B. mögliche Nebenwirkungen oder Wechselwirkungen mit anderen Medikamenten, die üblicherweise bei pädiatrischen Patienten verwendet werden.
- Laufende Überwachung und Aktualisierung: Nach der Zulassung eines Arzneimittels für die pädiatrische Verwendung können Studien nach der Zulassung erforderlich sein, um zusätzliche Daten über seine Sicherheit und Wirksamkeit zu sammeln. Diese können bei Bedarf zu Aktualisierungen der Kennzeichnung führen.
US Kennzeichnungsvorschriften für US
In den US hat die Food and Drug Administration (FDA) den Pediatric Research Equity Act (PREA) und den Best Pharmaceuticals for Children Act (BPCA) eingeführt, um die Forschung und Kennzeichnung von Kinderarzneimitteln zu fördern. Der PREA verpflichtet Pharmaunternehmen, pädiatrische Studien für bestimmte Arzneimittel durchzuführen, die wahrscheinlich bei Kindern angewendet werden. Der BPCA gewährt Unternehmen, die solche Studien durchführen, eine zusätzliche Marktexklusivität von sechs (06) Monaten.
Die FDA weitere Richtlinien FDA , um die Sicherheit, Wirksamkeit und richtige Dosierung von Kinderarzneimitteln wie folgt zu gewährleisten:
- Pädiatrische Studienpläne (PSP): Die Hersteller müssen Pläne für pädiatrische Studien zur Bewertung der Sicherheit und Wirksamkeit von Arzneimitteln vorlegen.
- Altersspezifische Informationen: Die Etiketten sollten altersgerechte Dosierungen, Indikationen und Sicherheitshinweise enthalten.
- Gewichtsabhängige Dosierung: Gewichtsabhängige Dosierungsempfehlungen gewährleisten eine genaue Verabreichung.
- Unerwünschte Wirkungen: Geben Sie pädiatriespezifische unerwünschte Wirkungen und Sicherheitsdaten an.
- Pädiatriespezifische Formulierungen: Medikamente benötigen möglicherweise pädiatriespezifische Darreichungsformen (z. B. Flüssigkeiten und Kautabletten).
- Human Factor Engineering: Die Etiketten sollten die einfache Handhabung für das Pflegepersonal berücksichtigen.
- Merkblätter für Patienten: Klare Anweisungen zur Verabreichung, Dosierung und zu den Nebenwirkungen sind erforderlich.
Die folgende Tabelle zeigt die Unterschiede und Gemeinsamkeiten zwischen den Kennzeichnungsvorschriften US der EU:
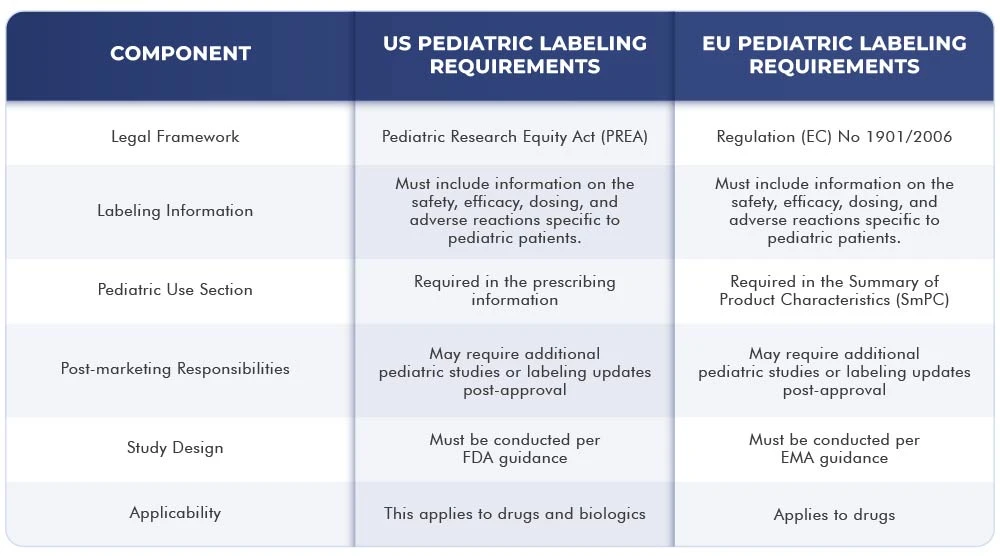
Schlussfolgerung
Die Anforderungen an die Kennzeichnung von Kinderarzneimitteln in der EU und US die sichere und angemessene Anwendung von Medikamenten bei Kindern gewährleisten. Zwar gibt es Ähnlichkeiten zwischen den beiden Rechtsrahmen, wie beispielsweise die Notwendigkeit pädiatrischer Studien und die Aufnahme pädiatriespezifischer Informationen in die Kennzeichnung von Arzneimitteln, doch gibt es auch bemerkenswerte Unterschiede. Das Verständnis dieser Ähnlichkeiten und Unterschiede ist für Pharmaunternehmen, Gesundheitsdienstleister und Aufsichtsbehörden von entscheidender Bedeutung, um sicherzustellen, dass Kinder Zugang zu sicheren und wirksamen Medikamenten haben.
Wenden Sie sich an einen bewährten Etikettierungsexperten wie Freyr die Einhaltung der länderspezifischen Etikettierungsvorschriften Freyr .









