Die Direktwerbung für Arzneimittel ist in den letzten Jahren zu einem beliebten Diskussionsthema geworden. Diese Werbung, die sich eher an die Verbraucher als an die Angehörigen der Gesundheitsberufe richtet, hat das Bewusstsein der Patienten und die Nachfrage nach bestimmten Arzneimitteln erhöht. Allerdings wurde auch kritisiert, dass sie möglicherweise zu Überdiagnosen und Überbehandlungen führen.
Angesichts der aktuellen Trends in Pharmaunternehmen ist bekannt, dass die Gesamtausgaben für Marketing höher sind als das Forschungsbudget. Weltweit wurden 1,42 Billionen US-Dollar für Marketing ausgegeben. In den USA wurden 2021 486,62 Milliarden US-Dollar für die Vermarktung von Medikamenten an Ärzte ausgegeben, in Kanada waren es 2022 29.305,1 Millionen US-Dollar. Bei einer Aufschlüsselung dieser Zahlen entfielen 56 % auf kostenlose Proben, 25 % auf „Detailing” (direkte Werbung für Medikamente) durch Pharmareferenten bei Ärzten, 12,5 % auf Direktwerbung bei Verbrauchern, 4 % auf Detailing in Krankenhäusern und 2 % auf Anzeigen in Fachzeitschriften2. Manchmal können negative Marketingpraktiken sowohl Patienten als auch Angehörige der Gesundheitsberufe beeinträchtigen.
Arten der Drogenwerbung
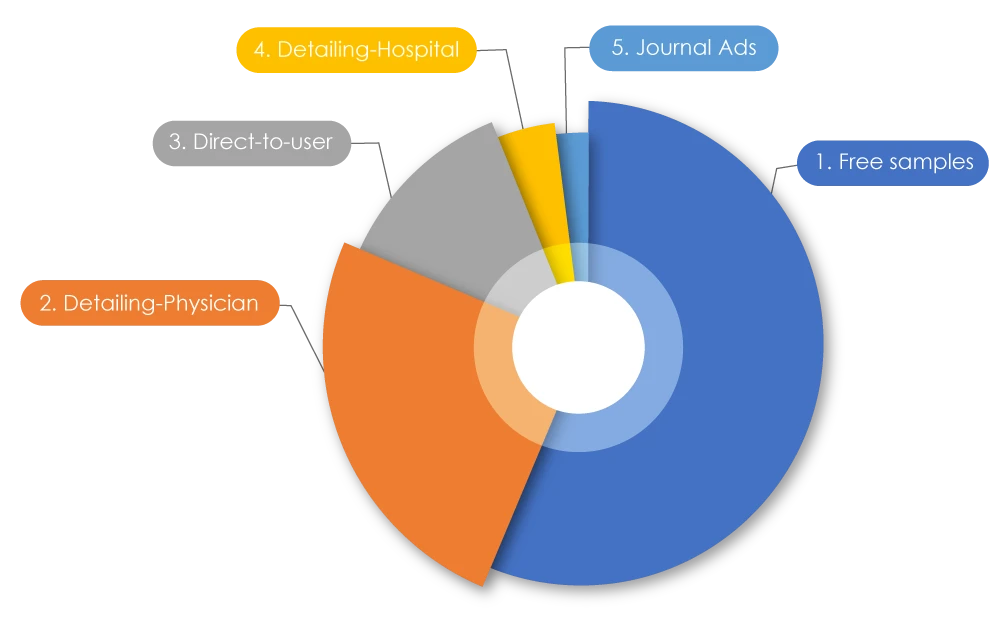
Quelle: Pharmazeutisches Marketing - Wikiwand
Pharmazeutische Werbung in der Öffentlichkeit
Die Werbung für verschreibungspflichtige Arzneimittel in der Öffentlichkeit, die auch als Direktwerbung bezeichnet wird, unterliegt Beschränkungen. Für die Werbung für verschreibungspflichtige Arzneimittel in der Öffentlichkeit muss die Mitteilung bestimmte grundlegende Anforderungen erfüllen:
- Die Übereinstimmung von Werbung und Verkaufsförderung für verschreibungspflichtige Arzneimittel mit der zugelassenen Verwendung hängt von der vorgesehenen Verwendung ab, für die das Produkt von der FDA zugelassen ist FDA die FDA Kennzeichnung des Arzneimittels). Die Kennzeichnung enthält Informationen darüber, wie das Produkt sicher und wirksam für die zugelassene Indikation verwendet werden kann. Werbung und Verkaufsförderung, die nicht mit der FDA Kennzeichnung übereinstimmen, gelten als unzulässige „Off-Label“-Werbung.
- Werbung für verschreibungspflichtige Medikamente erfordert ein faires Gleichgewicht zwischen den Vorteilen und Risiken des Produkts und stellt sicher, dass diese Informationen in ihrer Tiefe, ihren Einzelheiten und ihrem Kontext vergleichbar sind.
- Behauptungen sollten durch hinreichend stichhaltige Beweise oder klinische Erfahrungen belegt werden
- Wahrheitsgemäß und nicht irreführend - Wenn Werbung und Verkaufsförderung für verschreibungspflichtige Medikamente in irgendeiner Hinsicht falsch oder irreführend sind, werden sie nach dem Federal Food, Drug, and Cosmetic Act (FDCA) als "misbranded" betrachtet und unterliegen der Durchsetzung.
- Verwendung einer verbraucherfreundlichen Sprache, Vermeidung von Fachsprache, wissenschaftlichen Begriffen und medizinischem Jargon in verbraucherorientierter Werbung und Verkaufsförderung. Sie muss sich an die genehmigte Kennzeichnung oder Monographie des Produkts halten.
Informationen in der Arzneimittelwerbung für die breite Öffentlichkeit
Die Werbung und Verkaufsförderung für verschreibungspflichtige Arzneimittel, die sich an Verbraucher richtet, muss gemäß den Vorschriften des FDCA und der Food and Drug Administration (FDA) die folgenden Kernelemente enthalten.
- Geschützte und etablierte Namen sollten FDA entsprechen.
- Sie sollte die mengenmäßige Menge der Inhaltsstoffe des beworbenen Arzneimittels enthalten
- Er sollte eine "kurze Zusammenfassung" enthalten, in der jede Nebenwirkung, Warnung, Vorsichtsmaßnahme und Kontraindikation aufgeführt ist. Der Schwerpunkt liegt eher auf den wichtigen Risikoinformationen als auf einer erschöpfenden Liste der produktbezogenen Risiken. Die meisten Risiken werden so dargestellt, dass sie von den Verbrauchern am ehesten verstanden werden können.
- Die Hauptrisiken eines Produkts sollten klar, deutlich und neutral als "Hauptaussage" dargestellt werden.
- Die Offenlegungserklärungen zu unerwünschten Ereignissen für DTC-Werbung müssen die folgende MedWatch-Erklärung in auffälliger Schrift enthalten: „Sie werden gebeten, negative Nebenwirkungen von verschreibungspflichtigen Medikamenten der FDA zu melden. Besuchen Sie fda oder rufen Sie +1–800-FDA-1088 anFDA
- Erinnerungskennzeichnungen und Werbung sind von den allgemeinen Anforderungen ausgenommen. Wichtig ist, dass Erinnerungskennzeichnungen und Werbung für verschreibungspflichtige Medikamente mit einer Boxed Warning in der FDA Kennzeichnung nicht zulässig sind.
Für DTC-Arzneimittelwerbung kontaktieren Sie Us bitte.
Für DTC-Werbung für Arzneimittel
Beschränkungen für Interaktionen zwischen Patienten oder Patientenorganisationen und der Industrie
Interaktionen zwischen pharmazeutischen Unternehmen und Patienten/Patientenorganisationen sind nur in einigen wenigen Ländern wie den Vereinigten Staaten erlaubt, allerdings mit Einschränkungen, z. B:
- Muss On-Label/CFL sein
- Fair und ausgewogen
- Angemessen begründete und
- Nicht anderweitig falsch oder irreführend
Darüber hinaus dürfen Interaktionen mit Kunden nicht das Anti-Kickback-Gesetz verletzen, indem sie Patientenorganisationen oder Patienten dazu veranlassen, das beworbene Produkt zu empfehlen oder zu verwenden.
Im Vereinigten Königreich ist DTC-Werbung in der Öffentlichkeit für Arzneimittel erlaubt, Kinder sind jedoch davon ausgeschlossen. Die Werbung für verschreibungspflichtige Arzneimittel in der Öffentlichkeit ist verboten. Die Werbung sollte den Namen des Produkts und den Namen des Wirkstoffs enthalten. Produktproben oder Gutscheine, die es den Verbrauchern ermöglichen, das Produkt kostenlos oder zu einem unangemessen niedrigen Preis zu erhalten, sind nicht zulässig.
supDeutschland ist die Werbung für Arzneimittel ausschließlich für Kinder unter 14 Jahren zulässig. Die Werbung für verschreibungspflichtige Arzneimittel ist verboten. Es gibt jedoch auch Sonderregelungen für die Werbung für Arzneimittel außerhalb von Fachkreisen. Diese Sonderregelungen sind hauptsächlich im Heilmittelwerbegesetz (HWG) festgelegt und wurden durch das Arzneimittelgesetz (AMG) geändert, umsup mit der Richtlinie 2001/83/EG in Einklang zu bringen.
Debatte über die Möglichkeit der Arzneimittelwerbung im digitalen Era
Die Befürworter der DTC-Werbung für Arzneimittel argumentieren, dass die Patienten durch die Bereitstellung von Informationen über Behandlungsmöglichkeiten gestärkt werden. Sie weisen auch darauf hin, dass sie zu einer erhöhten Nachfrage nach Arzneimitteln führen kann, was für die Pharmaunternehmen von Vorteil sein kann.
Auf der anderen Seite argumentieren Kritiker der DTC-Werbung für Arzneimittel, dass sie zu Überdiagnosen und Überbehandlungen führen kann. Sie behaupten, dass in dieser Werbung die Vorteile von Arzneimitteln oft übertrieben und ihre Risiken heruntergespielt werden, was Patienten dazu veranlasst, ihre Ärzte um Medikamente zu bitten, die sie vielleicht gar nicht brauchen. Außerdem könne dies zu höheren Kosten im Gesundheitswesen führen, da den Patienten unter Umständen teurere Markenmedikamente statt billigerer Generika verschrieben würden.
Trotz der anhaltenden Debatte wird die DTC-Arzneimittelwerbung weiterhin bestehen bleiben. Die FDA Richtlinien für diese Art der Werbung herausgegeben, die Anforderungen hinsichtlich der Offenlegung von Risiken und einer ausgewogenen Darstellung von Nutzen und Risiken enthalten. Zusammenfassend lässt sich sagen, dass DTC-Arzneimittelwerbung das Potenzial hat, Patienten aufzuklären und die Nachfrage nach bestimmten Arzneimitteln zu steigern. Es ist jedoch auch wichtig, die potenziellen Nachteile zu berücksichtigen und sich der Grenzen der in diesen Werbungen bereitgestellten Informationen bewusst zu sein. Wie immer ist es wichtig, vor der Einnahme von Medikamenten Ihren Arzt zu konsultieren. Reach die Experten von Freyr, um end-to-end zu gewährleisten!