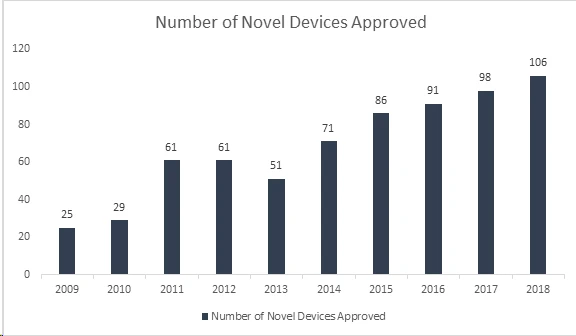
Sabia que a US and Drug Administration (FDA) US estabeleceu mais um recorde ao aprovar 106 novos dispositivos em 2018, tornando-o o ano mais bem-sucedido para dispositivos médicos? Com essa conquista, FDA o seu recorde de 40 anos, estabelecido em 2017, de aprovar 99 novos dispositivos, mostrando um crescimento contínuo nos últimos 8 anos. Os dispositivos aprovados incluem uma gama de produtos inovadores, como sistemas automatizados de dosagem de insulina para crianças, a menor válvula cardíaca do mundo para recém-nascidos, o primeiro aplicativo médico móvel para ajudar a controlar distúrbios relacionados ao abuso de opióides e substâncias, e tecnologias de inteligência artificial que diagnosticam retinopatia diabética.
FDA supsempre FDA a segurança e a inovação dos dispositivos médicos para garantir a sua alta qualidade. Para acompanhar o número crescente de aprovações de novos dispositivos e a sua segurança, FDA a planear «modernizar» o processo de aprovação de dispositivos médicos. De acordo com a agência, a modernização do processo de aprovação pode exigir uma nova autoridade. Em 2018, FDA o Centro de Dispositivos e Saúde Radiológica (CDRH) divulgaram um documento conjunto afirmando que o 510(k) era um dos dois tipos de submissão adicionados à definição de dispositivos novos. Juntamente com isso, as Isenções de Dispositivos Humanitários (HDEs) também foram adicionadas à definição de dispositivo novo após as alterações feitas no programa de dispositivos médicos inovadores do CDRH devido à Lei do Século XXI.
A proposta da FDA da CDRH é uma resposta à potencial necessidade de buscar nova autoridade para modernizar o processo 510(k). O motivo da proposta é limitar o uso de dispositivos predicados, como Substancialmente Equivalentes (SE), com mais de 10 anos, a fim de promover a inovação. É um passo à frente em relação à orientação divulgada pela agência em abril de 2018. O rascunho foi divulgado pela FDA propor a expansão do programa 510(k) abreviado no CDRH FDAsob o título – “Caminho baseado na segurança e no desempenho”. Foi introduzido para diminuir o peso das disposições sobre os dispositivos médicos. A abordagem também pretende aumentar a eficiência da revisão das submissões 510(k), reduzindo assim a pressão sobre a agência.
Eis alguns dos destaques das orientações:
- A nova via avalia a segurança e a eficácia dos dispositivos em função de normas estabelecidas de segurança e de indicadores de desempenho
- Apesar das novas normas, os dispositivos terão de cumprir as normas existentes para poderem ser comercializados
- A tecnologia moderna será testada em relação a normas modernas
- A abordagem conduzirá a uma maior concorrência para o desenvolvimento de dispositivos mais seguros
O número de dispositivos médicos que aparecem para aprovação aumentou exponencialmente ao longo dos anos. Isso deu à FDA ampla margem FDA adotar e implementar medidas inovadoras para melhorar os processos de aprovação. A agência acredita firmemente nos méritos dessa proposta, mas a resposta da indústria ainda não foi decifrada.
Com a FDA a apresentar novos documentos de orientação para atualizar o registo de dispositivos médicos, é necessário que os fabricantes de dispositivos médicos acompanhem essas mudanças e ajam em conformidade. Mantenha-se atualizado. Mantenha-se em conformidade.